
【题目】现有下列物质:CO2、N2、CaCl2、NH4Cl、NaOH、H2O2、Na2O2。
(1)属于共价化合物的有_______________,含有非极性键的离子化合物的是__________。
(2)N2、CO2的结构式分别为________________、_________________。
(3)分别写出NaOH、H2O2、Na2O2的电子式:_______________、_____________、______________。
【答案】 CO2、 H2O2 Na2O2 N≡N O=C=O ![]()
![]()
![]()
![]()
![]()
![]()
【解析】(1)本题考查化学键与物质类别,共价化合物属于是化合物,只含有共价键,CO2属于化合物,只有共价键,属于共价化合物,N2属于单质,不是共价键化合物,CaCl2属于离子化合物,只含离子键,NH4Cl属于离子化合物,含有离子键和共价键,NaOH属于离子化合物,含有离子键和共价键,H2O2属于共价化合物,含有极性共价键和非极性共价键,Na2O2属于离子化合物,含有离子键和非极性共价键,属于共价化合物的是CO2和H2O2,含有非极性键和离子键的是Na2O2;(2)N2中两个氮原子共用三个电子对,结构式为N≡N,CO2中C和O共用2个电子对,结构式为O=C=O;(3)电子式分别是![]()
![]() 、
、 ![]() 、
、 ![]()
![]() 。
。


科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B、C、D四种物质混合放入VL密闭容器中,发生如下反应:aA+bB![]() cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了0.5nmol,C增加了1.5n mol,D增加了n mol。此时反应达到平衡。
cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了0.5nmol,C增加了1.5n mol,D增加了n mol。此时反应达到平衡。
(1)以B的浓度变化表示的该反应的速率为v (B)= 。
(2)该化学方程式中,各物质的化学计量数分别为:a b c d
(3)若只改变压强,反应速率变化但平衡状态不移动,则各物质的聚集状态分别是:A B D 。若在上述平衡混合物中再加入B物质,上述平衡
A.向正反应方向移动 B.向逆反应方向移动
C.不移动 D.条件不够,无法判断
(4)若只升高温度,反应一段时间后,测知四种物质的物质的量又达到相等,则该反应为 反应。(填“放热”或“吸热”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已准确称量过的氯化钠固体配制1.00 mol·L-1的氯化钠溶液0.5 L,要用到的仪器是( )
①500 mL容量瓶 ②试管 ③烧瓶 ④胶头滴管 ⑤烧杯
⑥玻璃棒 ⑦托盘天平 ⑧药匙
A.①④⑤⑥
B.①②④⑤
C.①④⑤⑥⑦⑧
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在溶液中可发生以下反应:①16H++10Z-+2![]() ===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是( )
===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是( )
A.氧化性强弱顺序为:![]() <Z2<R2<M3+
<Z2<R2<M3+
B.还原性强弱顺序为:X2+<Z-<R-<M2+
C.Z元素在反应①中被氧化,在③中被还原
D.常温下可发生反应2M2++Z2===2M3++2Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA为阿伏加德罗常数的值)( )
A.28 g氮气含有的原子数为NA
B.4 g金属钙变成钙离子时失去的电子数为0.1NA
C.1 mol O2分子的质量等于1 mol氧原子的质量
D.24 g O2分子和24 g O3分子所含的氧原子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种有机物的结构简式如下图,关于它的性质不正确的说法是( )
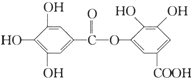
A.它有酸性,1 mol该物质最多能与6 mol H2发生加成反应
B.它可以水解,水解产物为两种有机物
C.在一定条件下,1 mol该物质最多能和8 mol NaOH反应
D.该有机物能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用Cl2生产某些含氯有机物时会产生副产物HCl。
利用反应A可实现氯的循环利用。反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.![]()
![]()
①写出此条件下,反应A的热化学方程式 。
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ。
(2)氢气用于工业合成氨 N2(g) + 3H2(g) ![]() 2NH3(g);ΔH = -92.2 kJ·mol-1。
2NH3(g);ΔH = -92.2 kJ·mol-1。
①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,正逆反应速率与时间的关系如下图所示,其中t4 ﹑t5 ﹑t7时刻对应的实验条件改变分别是t4 ;t5 ;t7 。
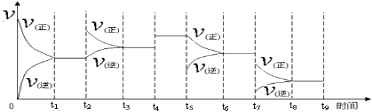
②温度为T℃时,将2nmolH2和nmolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则n= 。
(3)科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。
①写出铜电极表面的电极反应式 。
②为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“氢氧化钠”或“硫酸”)。
(4)传统制备肼的方法是以NaClO氧化NH3,制得肼(N2H4)的稀溶液。该反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬(Ⅵ)废水能诱发致癌,对人类和自然环境有严重的破坏作用。利用Cu2O光催化可以处理含有Cr2O72-的废水。
Ⅰ.制取Cu2O
(1)电解法:利用铜和钛做电极,电解含有NaCl和NaOH的溶液时,反应只消耗了铜和水,体系pH及Cl-浓度维持不变(溶液体积变化忽略不计)。
①阳极材料是_________。
②阴极的电极反应式是_________;电解总反应为:_________。
(2)还原法
①工业上可用肼(N2H4)与新制的Cu(OH)2反应制备纳米级Cu2O,同时放出N2,该反应的化学方程式为_________。
②控制100℃、pH=5的条件时,利用亚硫酸钠与硫酸铜溶液反应可以制得Cu2O,同时产生SO2气体。反应过程中需要不断地加入烧碱,其原因是_________。
Ⅱ.利用Cu2O光催化处理含有Cr2O72-的废水的研究。
(1)光照射到Cu2O光催化剂上产生光催化反应,Cr2O72-和H2O分别在光催化反应中形成的微电极上发生电极反应,反应原理如下图所示。
在图中用短线和箭头画出电子移动的方向,写出Cr2O72-转化Cr3+的电极反应_________。
(2)研究中对Cu2O的作用提出两种假设:
a.Cu2O作光催化剂;b.Cu2O 与Cr2O72-发生氧化还原反应。
已知:Cu2O的添加量是1.74×10-4 mol/L,Cr2O72-的初始浓度是9.60×10-4 mol/L;对比实验,反应1.5小时结果如下图所示。结合试剂用量数据和实验结果可得到的结论和依据是_______。
(3)溶液的pH对Cr2O72-降解率的影响如下图所示。
已知:Cu2O ![]() Cu +CuSO4;酸性越大,Cr2O72-被还原率越大。
Cu +CuSO4;酸性越大,Cr2O72-被还原率越大。
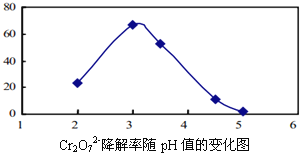
①由上图可知,pH分别为2、3、4时,Cr2O72-的降解率最好的是_________,其原因是_________。
②已知pH=5时,会产生Cr(OH)3沉淀。pH=5时,Cr2O72-的降解率低的原因是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com