
【题目】含铬(Ⅵ)废水能诱发致癌,对人类和自然环境有严重的破坏作用。利用Cu2O光催化可以处理含有Cr2O72-的废水。
Ⅰ.制取Cu2O
(1)电解法:利用铜和钛做电极,电解含有NaCl和NaOH的溶液时,反应只消耗了铜和水,体系pH及Cl-浓度维持不变(溶液体积变化忽略不计)。
①阳极材料是_________。
②阴极的电极反应式是_________;电解总反应为:_________。
(2)还原法
①工业上可用肼(N2H4)与新制的Cu(OH)2反应制备纳米级Cu2O,同时放出N2,该反应的化学方程式为_________。
②控制100℃、pH=5的条件时,利用亚硫酸钠与硫酸铜溶液反应可以制得Cu2O,同时产生SO2气体。反应过程中需要不断地加入烧碱,其原因是_________。
Ⅱ.利用Cu2O光催化处理含有Cr2O72-的废水的研究。
(1)光照射到Cu2O光催化剂上产生光催化反应,Cr2O72-和H2O分别在光催化反应中形成的微电极上发生电极反应,反应原理如下图所示。
在图中用短线和箭头画出电子移动的方向,写出Cr2O72-转化Cr3+的电极反应_________。
(2)研究中对Cu2O的作用提出两种假设:
a.Cu2O作光催化剂;b.Cu2O 与Cr2O72-发生氧化还原反应。
已知:Cu2O的添加量是1.74×10-4 mol/L,Cr2O72-的初始浓度是9.60×10-4 mol/L;对比实验,反应1.5小时结果如下图所示。结合试剂用量数据和实验结果可得到的结论和依据是_______。
(3)溶液的pH对Cr2O72-降解率的影响如下图所示。
已知:Cu2O ![]() Cu +CuSO4;酸性越大,Cr2O72-被还原率越大。
Cu +CuSO4;酸性越大,Cr2O72-被还原率越大。
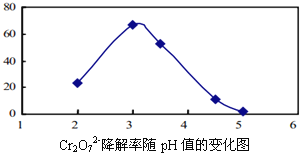
①由上图可知,pH分别为2、3、4时,Cr2O72-的降解率最好的是_________,其原因是_________。
②已知pH=5时,会产生Cr(OH)3沉淀。pH=5时,Cr2O72-的降解率低的原因是_______。
【答案】(11分)
Ⅰ、(1)①Cu;②2H2O+2e-=H2↑+2OH—;2Cu+H2O![]() H2↑+Cu2O;
H2↑+Cu2O;
(2)①N2H4+4Cu(OH)2=2Cu2O+N2↑+6H2O;②2CuSO4+3Na2SO3=Cu2O+2SO2↑+3Na2SO4
反应过程中溶液的酸性不断地增强,为调节pH所以需要加入烧碱;
Ⅱ.(1)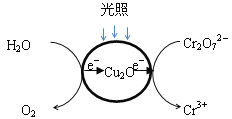 ;Cr2O72—+14H++6e-=2Cr3++ 7H2O;
;Cr2O72—+14H++6e-=2Cr3++ 7H2O;
(2)Cu2O作光催化剂。若发生氧化还原反应,则存在比例: 3Cu2O—Cr2O72-,计算9.60 × 10-4 × 3 × 69.5% = 2.00 × 10-3 > 1.74 × 10-4 mol/L;实验可以看到只有氧化亚铜和只有光照时,Cr2O72-的转化率很低,说明反应条件是光照条件下和Cu2O同时存在;
(3)①3pH<2.5时Cu2O会歧化(转化)为Cu 和Cu2+,所以不选pH=2;酸性越大,Cr2O72-被还原率越大,pH=3酸性强于pH=4的溶液,所以选择pH=3;②pH=5时,会产生Cr(OH)3沉淀,沉淀覆盖在催化剂Cu2O表面,影响反应继续进行;
【解析】
试题分析:Ⅰ.(1)①电解含有NaCl和NaOH的溶液时,反应只消耗了铜和水,因此需要选用铜做阳极,故答案为:Cu;
②阴极水电离出的氢离子放电生成氢气,电极反应式为2H2O +2e-=H2↑+ 2OH—;根据题意,阳极铜溶解生成Cu2O,电解总反应为2Cu +H2O ![]() H2↑+ Cu2O,故答案为:2H2O +2e-=H2↑+ 2OH—;2Cu +H2O
H2↑+ Cu2O,故答案为:2H2O +2e-=H2↑+ 2OH—;2Cu +H2O ![]() H2↑+ Cu2O;
H2↑+ Cu2O;
(2)①工业上可用肼(N2H4)与新制的Cu(OH)2反应制备纳米级Cu2O,同时放出N2,反应的化学方程式为N2H4+4Cu(OH)2=2Cu2O + N2↑+ 6H2O,故答案为:N2H4+4Cu(OH)2=2Cu2O + N2↑+ 6H2O;
②控制100℃、pH=5的条件时,利用亚硫酸钠与硫酸铜溶液反应可以制得Cu2O,同时产生SO2气体,反应的方程式为2CuSO4+3Na2SO3= Cu2O +2SO2↑+ 3Na2SO4,反应过程中溶液的酸性不断地增强,为调节pH所以需要加入烧碱,故答案为:2CuSO4+3Na2SO3= Cu2O +2SO2↑+ 3Na2SO4反应过程中溶液的酸性不断地增强,为调节pH所以需要加入烧碱;
Ⅱ.(1)根据图示,水失去电子发生氧化反应生成氧气,Cr2O72-得到电子发生还原反应生成Cr3+,图示为: ,Cr2O72-转化Cr3+的电极反应式为Cr2O72—+14H++6e-=2Cr3++ 7H2O,故答案为:
,Cr2O72-转化Cr3+的电极反应式为Cr2O72—+14H++6e-=2Cr3++ 7H2O,故答案为: ;Cr2O72—+14H++6e-=2Cr3++ 7H2O;
;Cr2O72—+14H++6e-=2Cr3++ 7H2O;
(2)根据图像,只有光照时,Cr2O72-的浓度不降低,只有Cu2O时,Cr2O72-的浓度降低很少,而二者同时存在时,Cr2O72-的浓度降低很大,说明Cu2O是光催化剂;同时,根据得失电子守恒,若Cu2O与Cr2O72-发生氧化还原反应,则有3Cu2O—Cr2O72-,计算得:9.60×10-4×3×69.5%=2.00×10-3>1.74×10-4mol/L,进一步说明,Cu2O作光催化剂,反应的条件是光照条件下和Cu2O同时存在,故答案为:Cu2O作光催化剂。若发生氧化还原反应,则存在3Cu2O—Cr2O72-比例关系:计算9.60×10-4×3×69.5%=2.00×10-3>1.74×10-4mol/L;实验可以看到只有氧化亚铜和只有光照时,Cr2O72-的转化率很低,说明反应条件是光照条件下和Cu2O同时存在;
(3)①由上图可知,Cr2O72-的降解率最好的是3,原因是pH<2.5时Cu2O会歧化(转化)为Cu 和Cu2+,所以不选pH=2;酸性越大,Cr2O72-被还原率越大,pH=3酸性强于pH=4的溶液,所以选择pH=3;,故答案为:3;pH<2.5时Cu2O会歧化(转化)为Cu 和Cu2+,所以不选pH=2;酸性越大,Cr2O72-被还原率越大,pH=3酸性强于pH=4的溶液,所以选择pH=3;
②pH=5时,会产生Cr(OH)3沉淀,沉淀覆盖在催化剂Cu2O表面,影响反应继续进行,使得Cr2O72-的降解率低,故答案为:pH=5时,会产生Cr(OH)3沉淀,沉淀覆盖在催化剂Cu2O表面,影响反应继续进行。


科目:高中化学 来源: 题型:
【题目】现有下列物质:CO2、N2、CaCl2、NH4Cl、NaOH、H2O2、Na2O2。
(1)属于共价化合物的有_______________,含有非极性键的离子化合物的是__________。
(2)N2、CO2的结构式分别为________________、_________________。
(3)分别写出NaOH、H2O2、Na2O2的电子式:_______________、_____________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示两个装置的叙述中不正确的是
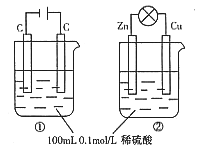
A.c(H+)浓度变化:①减小,②减小
B. 装置名称:①是电解池,②是原电池
C.离子移动方向:①中H+向阴极方向移动,②中H+向正极方向移动
D. 电极反应式:①中阳极:2H2O-4e-=4H++O2↑,②中负极中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8 960 mL的NO2气体和672 mL N2O4的气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02 g。则x等于( )
A. 8.64 g B. 9.20 g
C. 9.00 g D. 9.44 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Fe(NO3)3和Cu(NO3)2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示,则该溶液中Fe(NO3)3与Cu(NO3)2的物质的量浓度之比为
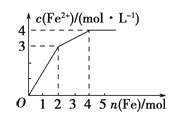
A.3∶1 B.1∶2 C.2∶1 D.1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法不正确的是 ( )
A. 二氯丙烷与六氯丙烷均有四种
B. C2H6和C6 H14一定互为同系物
C. 石油裂解和油脂皂化均是由高分子物质生成小分子物质的过程
D. 乙酸的酯化反应和蛋白质的水解反应均属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题。
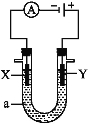
若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则:
(1)电解池中X极上的电极反应式是 ,在X极附近观察到的现象是 。
(2)Y电极上的电极反应式是 ,检验该电极反应产物的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】居室空气污染的主要来源之一是人们使用的装饰材料、胶合板、内墙涂料会释放出一种刺激性气味的物质,该物质是( )
A.甲烷 B.甲醛 C.氨气 D.二氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列配合物的水溶液中加入硝酸银不能生成沉淀的是
A. [Co(NH3)4Cl2] Cl
B. [Co(NH3)3Cl3]
C. [Co(NH3)6] Cl3
D. [Cu(NH3)4]Cl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com