
【题目】取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8 960 mL的NO2气体和672 mL N2O4的气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02 g。则x等于( )
A. 8.64 g B. 9.20 g
C. 9.00 g D. 9.44 g
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】常温下,在溶液中可发生以下反应:①16H++10Z-+2![]() ===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是( )
===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是( )
A.氧化性强弱顺序为:![]() <Z2<R2<M3+
<Z2<R2<M3+
B.还原性强弱顺序为:X2+<Z-<R-<M2+
C.Z元素在反应①中被氧化,在③中被还原
D.常温下可发生反应2M2++Z2===2M3++2Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用Cl2生产某些含氯有机物时会产生副产物HCl。
利用反应A可实现氯的循环利用。反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.![]()
![]()
①写出此条件下,反应A的热化学方程式 。
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ。
(2)氢气用于工业合成氨 N2(g) + 3H2(g) ![]() 2NH3(g);ΔH = -92.2 kJ·mol-1。
2NH3(g);ΔH = -92.2 kJ·mol-1。
①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,正逆反应速率与时间的关系如下图所示,其中t4 ﹑t5 ﹑t7时刻对应的实验条件改变分别是t4 ;t5 ;t7 。
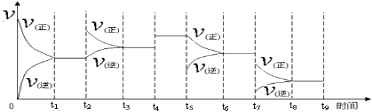
②温度为T℃时,将2nmolH2和nmolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则n= 。
(3)科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。
①写出铜电极表面的电极反应式 。
②为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“氢氧化钠”或“硫酸”)。
(4)传统制备肼的方法是以NaClO氧化NH3,制得肼(N2H4)的稀溶液。该反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于粗盐提纯的说法中正确的是( )
A.溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解
B.滤去不溶性杂质后,将滤液移至坩埚内加热浓缩
C.当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干
D.将制得的晶体转移到新制过滤器中用大量水进行洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个电化学过程的示意图。已知甲池的总反应式为2CH3OH+3O2+4KOH![]() 2K2CO3+6H2O
2K2CO3+6H2O
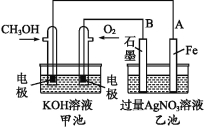
(1)请回答图中甲、乙两池的名称。
甲池是 装置,乙池是 装置。
(2)请回答下列电极的名称;
通入CH3OH的电极名称是 ,B(石墨)电极的名称是 。
(3)写出电极反应式;通入O2的电极的电极反应式为 。
A(Fe)电极的电极反应式为 。
(4)乙池中反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬(Ⅵ)废水能诱发致癌,对人类和自然环境有严重的破坏作用。利用Cu2O光催化可以处理含有Cr2O72-的废水。
Ⅰ.制取Cu2O
(1)电解法:利用铜和钛做电极,电解含有NaCl和NaOH的溶液时,反应只消耗了铜和水,体系pH及Cl-浓度维持不变(溶液体积变化忽略不计)。
①阳极材料是_________。
②阴极的电极反应式是_________;电解总反应为:_________。
(2)还原法
①工业上可用肼(N2H4)与新制的Cu(OH)2反应制备纳米级Cu2O,同时放出N2,该反应的化学方程式为_________。
②控制100℃、pH=5的条件时,利用亚硫酸钠与硫酸铜溶液反应可以制得Cu2O,同时产生SO2气体。反应过程中需要不断地加入烧碱,其原因是_________。
Ⅱ.利用Cu2O光催化处理含有Cr2O72-的废水的研究。
(1)光照射到Cu2O光催化剂上产生光催化反应,Cr2O72-和H2O分别在光催化反应中形成的微电极上发生电极反应,反应原理如下图所示。
在图中用短线和箭头画出电子移动的方向,写出Cr2O72-转化Cr3+的电极反应_________。
(2)研究中对Cu2O的作用提出两种假设:
a.Cu2O作光催化剂;b.Cu2O 与Cr2O72-发生氧化还原反应。
已知:Cu2O的添加量是1.74×10-4 mol/L,Cr2O72-的初始浓度是9.60×10-4 mol/L;对比实验,反应1.5小时结果如下图所示。结合试剂用量数据和实验结果可得到的结论和依据是_______。
(3)溶液的pH对Cr2O72-降解率的影响如下图所示。
已知:Cu2O ![]() Cu +CuSO4;酸性越大,Cr2O72-被还原率越大。
Cu +CuSO4;酸性越大,Cr2O72-被还原率越大。
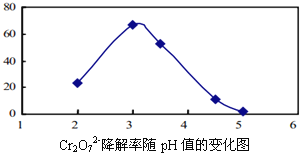
①由上图可知,pH分别为2、3、4时,Cr2O72-的降解率最好的是_________,其原因是_________。
②已知pH=5时,会产生Cr(OH)3沉淀。pH=5时,Cr2O72-的降解率低的原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
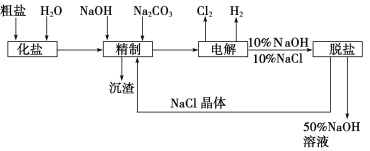
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的电极反应式为_________________,与电源负极相连的电极附近,溶液pH________(选填“不变”、“升高”或“下降”)。
(2)工业食盐中含Ca2+、Mg2+等杂质,精制过程中除去这些杂质时发生反应的离子方程式为__________________、__________________。
(3)如果粗盐中SO42-含量过高,必须添加钡试剂除去SO42-,该钡试剂可以是________(填写字母序号,下同)。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为________。
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、________(填写操作名称)除去NaCl。
(6)用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜法电解冷的食盐水时,Cl2与NaOH充分接触,得到的产物仅是NaClO和H2,则与该反应相应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行SO2的性质实验。在点滴板a、b、c处分别滴有不同的试剂,再向Na2SO3固体上滴加数滴浓H2SO4后,在整个点滴板上盖上培养皿,一段时间后观察到的实验现象如下表所示。
序号 | 试剂 | 实验现象 |
|
a | 品红溶液 | 红色褪去 | |
b | 酸性KMnO4溶液 | 紫色褪去 | |
c | NaOH溶液(含2滴酚酞) | 红色褪去 |
下列说法正确的是
A. 浓硫酸与Na2SO3固体发生了氧化还原反应
B. a、b均表明SO2具有漂白性
C. c中只可能发生反应:SO2+ 2OH—= SO32—+ H2O
D. c中所得溶液的离子浓度一定存在关系:c(Na+)+c(H+) = 2c(SO32—) +c(HSO3) + c(OH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com