
����Ŀ���ȼ��ⱥ��ʳ��ˮ��ȡNaOH�Ĺ�������ʾ��ͼ���£�
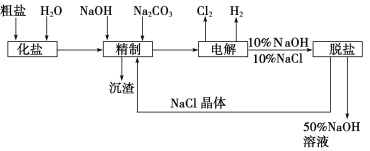
������ͼ�����������գ�
(1)�ڵ������У����Դ���������ĵ缫����������Ӧ�ĵ缫��ӦʽΪ_________________�����Դ���������ĵ缫��������ҺpH________(ѡ����䡱�������ߡ����½���)��
(2)��ҵʳ���к�Ca2����Mg2�������ʣ����ƹ����г�ȥ��Щ����ʱ������Ӧ�����ӷ���ʽΪ__________________��__________________��
(3)���������SO42���������ߣ��������ӱ��Լ���ȥSO42�����ñ��Լ�������________(��д��ĸ��ţ���ͬ)��
A��Ba(OH)2 B��Ba(NO3)2 C��BaCl2
(4)Ϊ��Ч��ȥCa2����Mg2����SO42���������Լ��ĺ���˳��Ϊ________��
A���ȼ�NaOH�����Na2CO3���ټӱ��Լ�
B���ȼ�NaOH����ӱ��Լ����ټ�Na2CO3
C���ȼӱ��Լ������NaOH���ټ�Na2CO3
(5)���ι���������NaOH��NaCl���ܽ���ϵIJ��죬ͨ��________����ȴ��________(��д��������)��ȥNaCl��
(6)�ø�Ĥ�����ʳ��ˮʱ�����۷ָ�Ϊ������������������ֹCl2��NaOH��Ӧ��������Ĥ��������ʳ��ˮʱ��Cl2��NaOH��ֽӴ����õ��IJ������NaClO��H2������÷�Ӧ��Ӧ�Ļ�ѧ����ʽΪ___________________��
���𰸡�(1)2Cl����2e��==Cl2�� ����
(2)Ca2����CO32��==CaCO3��
Mg2����2OH��==Mg(OH)2��
(3)AC (4)BC (5)���� ����
(6)NaCl��H2O![]() NaClO��H2��
NaClO��H2��
(��2NaCl��2H2O![]() H2����Cl2����2NaOH��Cl2��2NaOH==NaCl��NaClO��H2O)
H2����Cl2����2NaOH��Cl2��2NaOH==NaCl��NaClO��H2O)
��������(1)��ⱥ��ʳ��ˮ�����Դ���������ĵ缫Ϊ�������缫��Ӧʽ��2Cl����2e��==Cl2�������Դ���������ĵ缫Ϊ�������缫��Ӧʽ��2H����2e��==H2��������H��������OH����������Һ��pH���ߡ�
(2)��ȥCa2����Ca2����CO32��==CaCO3������ȥMg2����Mg2����2OH��==Mg(OH)2��������Mg(OH)2���ܽ�����С��MgCO3������Mg2����CO32����OH�����ʱ��һ��������Mg(OH)2������
(3)��ȥSO42����Ӧѡ��Ba2�����������Ba(NO3)2����Һ�л������µ����ʣ�����Ba(OH)2��BaCl2���������µ����ʣ�ѡA��C��
(4)��ȥ����ʱ����Ba2����OH�������Ⱥ�֮�֣���Na2CO3һ��Ҫ�������룬��ΪCO32����Ҫ��ȥ�����Ba2�������˳�������ΪNaCl���ᴿ��ѡB��C��
(5)����ʵ�����Ƿ���NaOH��NaCl������NaCl�ܽ��С�����NaCl�����������������������������ȴ���ᾧ�������˵�NaCl���壬��Һ��һ�����Ƶ�NaOH��
(6)��2NaCl��2H2O![]() 2NaOH��H2����Cl2����Cl2��2NaOH==NaCl��NaClO��H2O�ϲ������ɵó��𰸡�
2NaOH��H2����Cl2����Cl2��2NaOH==NaCl��NaClO��H2O�ϲ������ɵó��𰸡�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������άF ��ά��J�ĺϳ�·�����£�
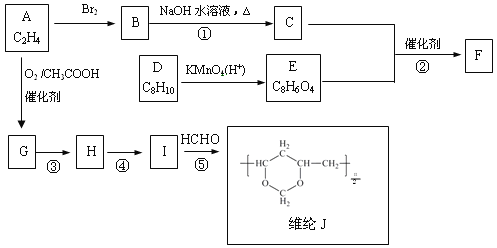
��֪��
1����ϩ�����ȶ�����Ѹ��ת��Ϊ��ȩ
2��CH2=CH2 +1/2O2 + CH3COOH![]() CH2=CHOOCCH3 + H2O
CH2=CHOOCCH3 + H2O
3 �� +H2O
+H2O
(1)G�й����ŵ�������
(2)C�Ľṹ��ʽ��
(3)������D��һ�ȴ���ֻ�����֣���D�Ľṹ��ʽ��
(4)��Ӧ���ķ�Ӧ������
(5)��Ӧ�������Ļ�ѧ����ʽ�ֱ��ǣ�
��Ӧ��
��Ӧ��
(6)��֪��![]() ��EҲ����A��2��4-����ϩΪԭ���Ʊ�����д���úϳ�·��(���Լ���ѡ)��
��EҲ����A��2��4-����ϩΪԭ���Ʊ�����д���úϳ�·��(���Լ���ѡ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡx gͭþ�Ͻ���ȫ����Ũ�����У���Ӧ���������ᱻ��ԭֻ����8 960 mL��NO2�����672 mL N2O4������(�������㵽��״̬)���ڷ�Ӧ�����Һ�м�����������������Һ�����ɳ�������Ϊ17.02 g����x���ڣ� ��
A. 8.64 g B. 9.20 g
C. 9.00 g D. 9.44 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л��������˵������ȷ���� ( )
A. ���ȱ��������ȱ����������
B. C2H6��C6 H14һ����Ϊͬϵ��
C. ʯ���ѽ����֬���������ɸ߷�����������С�������ʵĹ���
D. �����������Ӧ�͵����ʵ�ˮ�ⷴӦ������ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�á���ͼ��ʾһ�����أ�װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ��������ش��������⡣
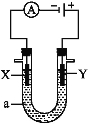
��X��Y���Ƕ��Ե缫��a�DZ���NaCl��Һ��ʵ�鿪ʼʱ��ͬʱ�����߸����뼸�η�̪��Һ����
(1)������X���ϵĵ缫��Ӧʽ�� ����X�������۲쵽�������� ��
(2)Y�缫�ϵĵ缫��Ӧʽ�� ������õ缫��Ӧ����ķ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����������з�Ӧ��2Cu��=Cu2����Cu��������ԭ����ͭʵ�����ڷ�Ӧ�¶Ȳ�ͬ�����ܲ���Cu��Cu2O�����߶��Ǻ�ɫ���塣ijͬѧ��ij��������ԭ����ͭ�ĺ�ɫ���������������ʵ�飬ʵ�������ʵ�������б����£�
���� �Լ� | ϡ���� | Ũ���� ������ | ϡ���� | Ũ���� |
ʵ�� ���� | ��ɫ���� ����Ӧ | ��ɫ���� | ��ɫ���� ��ɫ��Һ | ����ɫ���� ��ɫ��Һ |
�ɴ��Ƴ�����������ԭ����ͭʵ��IJ���(����)
A. ��Cu B. ��Cu2O C. һ����Cu��һ����Cu2O D. һ����Cu2O��������Cu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ҿ�����Ⱦ����Ҫ��Դ֮һ������ʹ�õ�װ�β��ϡ����ϰ塢��ǽͿ�ϻ��ͷų�һ�ִ̼�����ζ�����ʣ����������� ��
A������ B����ȩ C������ D����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��R��T��Q��W��Ԫ�����ڱ��е����λ����ͼ��ʾ������T������������������������ȣ������жϲ���ȷ���ǣ� ��
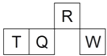
A. �����̬�⻯������ȶ��ԣ�R��Q
B. ����������Ӧˮ��������ԣ�Q��W
C. ԭ�Ӱ뾶��T��Q��R
D. ��T�����У�TԪ��ֻ�ܴ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����CH3OH(g)��![]() O2(g)=CO2(g)��2H2O(g) ��H����a kJ��mol
O2(g)=CO2(g)��2H2O(g) ��H����a kJ��mol
��CO(g)��![]() O2(g)=CO2(g) ��H����b kJ��mol
O2(g)=CO2(g) ��H����b kJ��mol
��H2(g)��![]() O2(g)=H2O(g) ��H����c kJ��mol
O2(g)=H2O(g) ��H����c kJ��mol
��H2(g)��![]() O2(g)=H2O(l) ��H����d kJ��mol
O2(g)=H2O(l) ��H����d kJ��mol
������������ȷ����
A. �������Ȼ�ѧ����ʽ��֪d��c
B. H2��ȼ����Ϊd kJ��mol
C. CH3OH(g)=CO(g)��2H2(g) ��H��(b��2c��a)kJ��mol
D. ��CO��H2�����ʵ���֮��Ϊ1��2ʱ������ȫȼ������CO2��H2O(l)ʱ���ų�Q kJ��������������CO�����ʵ���Ϊ![]() mol
mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com