
【题目】(1)用Cl2生产某些含氯有机物时会产生副产物HCl。
利用反应A可实现氯的循环利用。反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.![]()
![]()
①写出此条件下,反应A的热化学方程式 。
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ。
(2)氢气用于工业合成氨 N2(g) + 3H2(g) ![]() 2NH3(g);ΔH = -92.2 kJ·mol-1。
2NH3(g);ΔH = -92.2 kJ·mol-1。
①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,正逆反应速率与时间的关系如下图所示,其中t4 ﹑t5 ﹑t7时刻对应的实验条件改变分别是t4 ;t5 ;t7 。
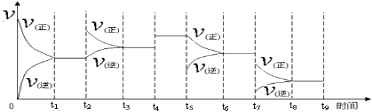
②温度为T℃时,将2nmolH2和nmolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则n= 。
(3)科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。
①写出铜电极表面的电极反应式 。
②为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“氢氧化钠”或“硫酸”)。
(4)传统制备肼的方法是以NaClO氧化NH3,制得肼(N2H4)的稀溶液。该反应的离子方程式是 。
【答案】(1)①4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)ΔH=-115.6kJ·mol-1②31.9
2Cl2(g)+2H2O(g)ΔH=-115.6kJ·mol-1②31.9
(2)①t4加入催化剂;t5减小NH3浓度;t7降温;②1
(3)①CO2+8e-+8H+=CH4+2H2O;②硫酸(4)ClO-+2NH3=N2H4+Cl-+H2O
【解析】
试题分析:(1)①依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应的热化学方程式为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol;
②设H—O键的键能为x,H—Cl键的键能为y,则有-115.6=-2×243-4x+4y+498,化简得x-y=31.9,即断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为31.9kJ。
(2)①t4时刻正逆反应速率均增大,但平衡不移动,由于正反应是体积减小的可逆反应,所以改变的条件只能是加入催化剂;t5时刻正反应速率不变,逆反应速率减小,平衡向正反应方向进行,所以改变的条件是减小NH3浓度;t7时刻正逆反应速率均减小,平衡向正反应方向进行,所以改变的条件是降低温度;
②根据热化学方程式可知参加反应的氮气的物质的量是46.1 kJ÷92.2 kJ·mol-1=0.5mol,由于氮气的转化率是50%,则n×0.5=0.5mol,所以n=1;
(3)①根据示意图可知铜电极表面产生甲烷,这说明CO2得到电子结合氢离子转化为甲烷,同时还有水生成,因此电极反应式为CO2+8e-+8H+=CH4+2H2O。
②由于正极需要消耗氢离子,所以为提高该人工光合系统的工作效率,可向装置中加入少量硫酸。
(4)NaClO氧化NH3,氧化产物是肼(N2H4),还原产物是氯化钠,根据原子守恒可知还有水生成,因此该反应的离子方程式是ClO-+2NH3=N2H4+Cl-+H2O。


科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,下列说法不能表明反应A(s)+2B(g)![]() C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
A.B的物质的量浓度 B.混合气体的压强不变
C.混合气体的密度 D.混合气体的相对分子质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:CO2、N2、CaCl2、NH4Cl、NaOH、H2O2、Na2O2。
(1)属于共价化合物的有_______________,含有非极性键的离子化合物的是__________。
(2)N2、CO2的结构式分别为________________、_________________。
(3)分别写出NaOH、H2O2、Na2O2的电子式:_______________、_____________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚酯纤维F 和维纶J的合成路线如下:
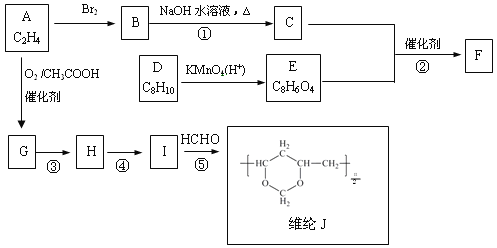
已知:
1.乙烯醇不稳定,会迅速转化为乙醛
2.CH2=CH2 +1/2O2 + CH3COOH![]() CH2=CHOOCCH3 + H2O
CH2=CHOOCCH3 + H2O
3 . +H2O
+H2O
(1)G中官能团的名称是
(2)C的结构简式是
(3)芳香烃D的一氯代物只有两种,则D的结构简式是
(4)反应③的反应类型是
(5)反应②和⑤的化学方程式分别是:
反应②
反应⑤
(6)已知:![]() 。E也可由A和2,4-己二烯为原料制备,请写出该合成路线(无机试剂任选)。
。E也可由A和2,4-己二烯为原料制备,请写出该合成路线(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL物质的量浓度为4.4 mol/L,密度为1.24 g/mL的稀硫酸的质量分数为( )
A.35%
B.70%
C.17.5%
D.0.035%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2(g)与H2(g)在铁催化剂表面经历如下过程生成NH3(g):
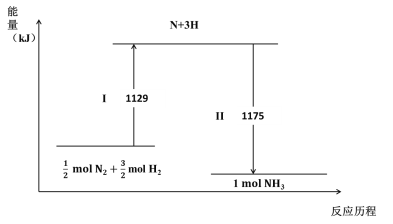
下列说法不正确的是
A.Ⅰ过程中破坏的均为非极性键
B.Ⅰ过程吸收能量,II过程放出能量
C. N2(g) + 3H2(g) ![]() 2NH3(g) ΔH = –44 kJ·mol-1
2NH3(g) ΔH = –44 kJ·mol-1
D.1mol N2(g)与3 mol H2(g)所具有的总能量比2 mol NH3(g) 所具有的总能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示两个装置的叙述中不正确的是
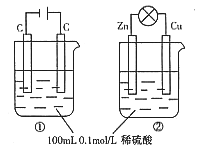
A.c(H+)浓度变化:①减小,②减小
B. 装置名称:①是电解池,②是原电池
C.离子移动方向:①中H+向阴极方向移动,②中H+向正极方向移动
D. 电极反应式:①中阳极:2H2O-4e-=4H++O2↑,②中负极中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8 960 mL的NO2气体和672 mL N2O4的气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02 g。则x等于( )
A. 8.64 g B. 9.20 g
C. 9.00 g D. 9.44 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】居室空气污染的主要来源之一是人们使用的装饰材料、胶合板、内墙涂料会释放出一种刺激性气味的物质,该物质是( )
A.甲烷 B.甲醛 C.氨气 D.二氧化硫
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com