
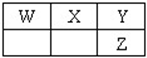
 如图是元素周期表主族元素的一部分.短周期元素X的最高正价是+5价,Y单质可在空气中燃烧.下列说法正确的是( )
如图是元素周期表主族元素的一部分.短周期元素X的最高正价是+5价,Y单质可在空气中燃烧.下列说法正确的是( )A、Z的元素符号是S,原子结构示意图为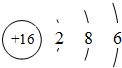 | B、W、X、Y、Z的气态氢化物的稳定性依次减弱 | C、W、X、Y的最高价氧化物对应水化物的酸性依次增强 | D、Y有两种常见的同素异形体,化学式分别为Y2与Y3 |
 ,故A错误;
,故A错误;

科目:高中化学 来源: 题型:
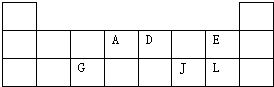 (2010?徐汇区二模)如图为元素周期表的短周期部分.请填空.
(2010?徐汇区二模)如图为元素周期表的短周期部分.请填空.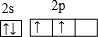

查看答案和解析>>
科目:高中化学 来源: 题型:

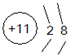
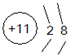


查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
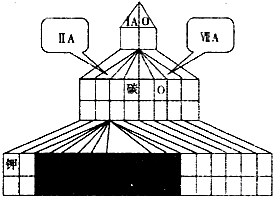
如图是元素周期表框架
(1)在上面元素周期表中画出主族元素与副族元素的分界线。
(2)下列说法正确的是 。
A.周期表中的主族都有非金属元素 B.周期表中的主族都有金属元素
C.周期表中的非金属元素都位于短周期 D.周期表中的非金属元素都位于主族
(3)现有甲、乙两种元素,甲元素原子核外2p亚层上有4个电子,乙元素的焰色反应显黄色。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应位置。
② 甲元素与硫元素相比较,非金属性较强的是 (填元素符号),写出可以验证该结论的一个化学反应方程式 。
③ 甲乙两种元素反应可能生成的产物是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com