
【题目】实验室制备1,2—二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。
用少量溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示:
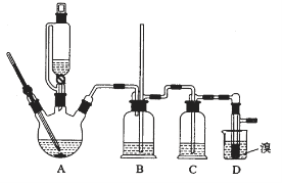
有关数据列表如下:
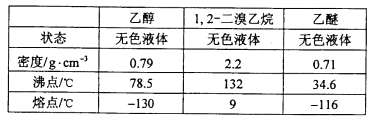
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是________;(填正确选项前的字母)
a. 引发反应 b. 加快反应速度
c. 防止乙醇挥发 d. 减少副产物乙醚生成
(2)在装置C中应加入________,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a 水 b 浓硫酸 c 氢氧化钠溶液 d 饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的方法是D装置中____________________________;
(4)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,溶液分层,产物应在______层(填“上”“下”);分离该有机物的方法叫_______________。
(5)若产物中有少量乙醚生成,最好用__________除去;(填正确选项前的字母)
a蒸发 b 蒸馏 c 重结晶
(6)反应过程中应用冷水冷却装置D,其主要目的是____________________。
【答案】d c 溴的颜色完全褪去 下 分液 b 冷却可避免溴的大量挥发
【解析】
装置A是乙醇在浓硫酸的存在下在170℃脱水生成乙烯,浓硫酸的强氧化性、脱水性导致制得的乙烯气体中含有杂质二氧化硫、二氧化碳、水蒸气等杂质,通过装置B中长玻璃管内液面上升或下降调节装置内压强,根据B中玻璃管中内外液面高低变化,可以判断是否发生堵塞;二氧化碳、二氧化硫等酸性气体能和氢氧化钠溶液反应,装置C是利用氢氧化钠溶液吸收杂质气体,溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,装置D冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,否则会使产品凝固而堵塞导管,1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,所以加水,振荡后静置,产物应在下层,分离得到产品;
(1)乙醇在浓硫酸140℃的条件下,发生分子间脱水生成乙醚;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色;
(4)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大;
(5)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离;
(6)溴易挥发,冷却防止溴大量挥发;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而堵塞导管。
(1)乙醇在浓硫酸140℃的条件下,发生分子间脱水生成乙醚,可能迅速地把反应温度提高到170℃左右,其最主要目的是:减少副产物乙醚生成,选择d;故答案为d;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应而被吸收,故选c,故答案为c;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,D中溴颜色完全褪去说明反应已经结束;
(4)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,有机层在下层,分离时用分液漏斗采用分液操作分离;
(5)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离,故答案为b;
(6)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,使溴充分反应。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有下列几种有机物:
A.CH4 B.(CH3)2C=CH-CH3 C.C7H16 D.CH2=CH—CH=CH2 E.环戊烷
(1)上述有机物中互为同系物的是_____________,互为同分异构体的是____________。
(2)1molE完全燃烧消耗氧气的物质的量____________________。
(3)C与Cl2反应的类型为_____________;D使溴水褪色的反应类型为___________。
(4)B在催化剂条件下发生加聚反应的化学方程式为_________________________。
(5)C的同分异构体中含有三个支链的结构简式______________,其系统命名为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g),下列可以判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g),下列可以判断该分解反应已经达到化学平衡状态的是( )
A. 2v(NH3)=v(CO2) B. 密闭容器中总压强不变
C. 密闭容器中混合气体的平均摩尔质量不变 D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代“药金”的冶炼方法是:将炉甘石(ZnCO3)和赤铜矿(Cu2O)与木炭按一定的比例混合后加热至800℃,即可炼出闪烁似金子般光泽的“药金”。下列叙述正确的是( )
A. “药金”实质上是铜锌合金
B. 冶炼炉中炉甘石直接被木炭还原为锌
C. 用王水可区别黄金和“药金”
D. 用火焰灼烧不能区别黄金和药金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g) = CO2(g)+3H2(g) △H = + 49. 0 kJ·mol-1②CH3OH(g)+ ![]() O2(g) = CO2(g)+2H2(g) △H =-192. 9 kJ·mol-1,下列说法正确的是
O2(g) = CO2(g)+2H2(g) △H =-192. 9 kJ·mol-1,下列说法正确的是
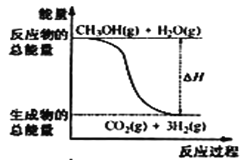
A.CH3OH的燃烧热为192. 9 kJ·mol-1
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l) +![]() O2(g) = CO2(g) +2H2(g) △H >-192. 9kJ·mol-1
O2(g) = CO2(g) +2H2(g) △H >-192. 9kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试从化学键的角度理解化学反应中的能量变化。(以2H2+O2===2H2O为例说明),已知:E反表示反应物(2H2+O2)所具有的总能量,E生表示生成物(2H2O)所具有的总能量。又知:拆开1moL H2中的化学键需要吸收436kJ能量,拆开1moL O2中的化学键需要吸收496kJ能量,形成水分子中的1moLH—O键能够释放463KJ能量。
⑴从宏观角度看:反应物所具有的总能量高于生成物所具有的总能量,所以该反应要______(填“吸收”或“放出”)能量,能量变化值的大小△E=_________(用E反和E生表示)
⑵从微观角度看:断裂反应物中的化学键吸收的总能量为E吸=______KJ;形成生成物中的化学键放出的总能量为=______KJ。E吸______E放(填“>”或“<”),所以该反应要_____(填“吸收”或“放出”)能量,能量变化值的大小△E=____ KJ(填数值)
⑶由图可知,化学反应的本质是________________________________化学反应中能量变化的主要原因是________________(从总能量说明)
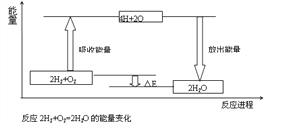
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A.CH2=CHCOOH和CH2=CH(CH2 )4 COOH B.12C60和石墨 C.![]() 和
和![]() D.35Cl和37Cl E.乙醇和乙二醇
D.35Cl和37Cl E.乙醇和乙二醇
(1)互为同位素的是________;
(2)互为同系物的是________;
(3)互为同素异形体的是________;
(4)互为同分异构体的是________;
(5)既不是同系物,又不是同分异体,也不是同素异形体,但可看成是同一类物质的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.某盐溶液呈酸性,该盐不可能是弱酸与弱碱反应生成的盐
B.向氨水中不断通入CO2气体,溶液中c(OH-)/c(NH3·H2O)相应减小
C.CH3Cl(g)+Cl2(g) ![]() CH2Cl2(l)+HCl(g);常温下能自发进行,则该反应的△H>0
CH2Cl2(l)+HCl(g);常温下能自发进行,则该反应的△H>0
D.硫酸工业中的反成,2SO2(g)+O2(g)![]() 2SO3(g)△H<0,采用500℃左右的高温主要是为了加快反应速率。
2SO3(g)△H<0,采用500℃左右的高温主要是为了加快反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某无结晶水的正盐X(仅含有两种短周期元素)的组成和性质,设计并完成下列实验。(气体体积已转化为标准状况下的体积)
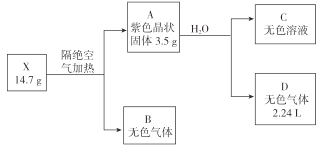
已知:B是空气的主要成分之一;C是一种强碱,且微溶于水 ,载人宇宙飞船内常用含 C的过滤网吸收宇航员呼出的CO2,以净化空气;D遇湿润的红色石蕊试纸变蓝。
(1)X的化学式为 __________________ 。
(2)图中B的组成元素在元素周期表中的位置是______________。
(3)A的电子式为 ____________。
(4)X受热分解转变成 A 和 B 的化学反应方程式为 ____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com