
【题目】下列说法正确的是
A.某盐溶液呈酸性,该盐不可能是弱酸与弱碱反应生成的盐
B.向氨水中不断通入CO2气体,溶液中c(OH-)/c(NH3·H2O)相应减小
C.CH3Cl(g)+Cl2(g) ![]() CH2Cl2(l)+HCl(g);常温下能自发进行,则该反应的△H>0
CH2Cl2(l)+HCl(g);常温下能自发进行,则该反应的△H>0
D.硫酸工业中的反成,2SO2(g)+O2(g)![]() 2SO3(g)△H<0,采用500℃左右的高温主要是为了加快反应速率。
2SO3(g)△H<0,采用500℃左右的高温主要是为了加快反应速率。
【答案】BD
【解析】
A.NH3·H2O是弱碱,H3PO4是弱酸,反应生成的NH4H2PO4溶于水呈酸性,A错误;
B.NH3·H2O的电离平衡常数![]() ,可得
,可得![]() ,随着CO2的通入,CO2会NH3·H2O反应生成(NH4)2CO3,溶液中NH4+的浓度增大,该比值减小,B正确;
,随着CO2的通入,CO2会NH3·H2O反应生成(NH4)2CO3,溶液中NH4+的浓度增大,该比值减小,B正确;
C.反应能否自发进行的判据:△H-T△S<0,反应CH3Cl(g)+Cl2(g)![]() CH2Cl2(l)+HCl(g),其熵减小;若常温下能自发进行,则△H<0,C错误;
CH2Cl2(l)+HCl(g),其熵减小;若常温下能自发进行,则△H<0,C错误;
D.2SO2(g)+O2(g)![]() 2SO3(g)△H<0,这是一个放热反应,升高温度平衡会向逆方向移动,不利于生成SO3,采用500℃左右的高温是因为催化剂在此温度下活性最大,主要是为了加快反应速率,D正确。
2SO3(g)△H<0,这是一个放热反应,升高温度平衡会向逆方向移动,不利于生成SO3,采用500℃左右的高温是因为催化剂在此温度下活性最大,主要是为了加快反应速率,D正确。
答案选BD。


科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是( )
①![]() ②
②![]() ③(CH3)3C—CHBr2 ④CHCl2—CHBr2 ⑤
③(CH3)3C—CHBr2 ④CHCl2—CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A. ①③⑥B. ②③⑤C. ②④D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
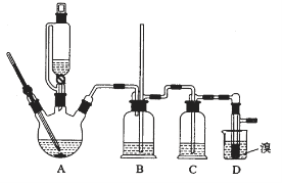
【题目】实验室制备1,2—二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。
用少量溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示:
有关数据列表如下:
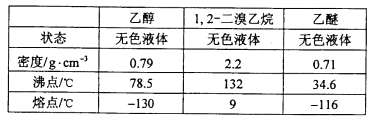
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是________;(填正确选项前的字母)
a. 引发反应 b. 加快反应速度
c. 防止乙醇挥发 d. 减少副产物乙醚生成
(2)在装置C中应加入________,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a 水 b 浓硫酸 c 氢氧化钠溶液 d 饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的方法是D装置中____________________________;
(4)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,溶液分层,产物应在______层(填“上”“下”);分离该有机物的方法叫_______________。
(5)若产物中有少量乙醚生成,最好用__________除去;(填正确选项前的字母)
a蒸发 b 蒸馏 c 重结晶
(6)反应过程中应用冷水冷却装置D,其主要目的是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气的主要成分有CO、SO2、NO、NO2等。
(1)利用氨水可以将SO2、NO2吸收,原理如下图所示。
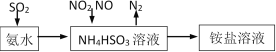
请写出NO2被吸收反应的离子方程式___________________。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:反应Ⅰ:2NO(g)+O2(g)==2NO2(g) ΔH1 =—113.0 kJ·molˉ1
反应Ⅱ:2SO2(g)+O2(g)==2SO3(1) ΔH2 =—288.4 kJ·molˉ1
反应Ⅲ:3NO2(g)+H2O(g)==2HNO3+NO(g) ΔH3 =—138.0 kJ·molˉ1
则反应NO2(g)+SO2(g)==NO(g)+SO3(1) ΔH4= _______________。
②已知TiO2催化尾气降解原理可表示为:2CO(g)+O2(g) ![]() 2CO2(g) ΔH5; 2H2O(g)+4NO(g)+3O2(g)
2CO2(g) ΔH5; 2H2O(g)+4NO(g)+3O2(g) ![]() 4HNO3(g) ΔH6。
4HNO3(g) ΔH6。
在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如图所示。请解释ts后NO降解率下降的可能原因_____________________。

(3)沥青混凝土也可降解CO。如图为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合如图回答下列问题:
①已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L—1,求此温度下CO降解反应的平衡常数_______________。
②下列关于如图的叙述正确的是_________________
A.降解率由b点到c点随温度的升高而增大,可知CO降解反应的平衡常数Kb<Kc
B.相同温度下β型沥青混凝土中CO降解速率比α型要大
C.d点降解率出现突变的原因可能是温度升高后催化剂失效
③科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10℃~60℃范围内进行实验,请在如图中用线段与“![]() ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围_____________。
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围_____________。
(4)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式 ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列颜色变化与氧化还原反应无关的是
A. 将乙醇滴入酸性K2Cr2O7溶液中,溶液由橙色变为绿色
B. 将葡萄糖溶液加入新制Cu(OH)2悬浊液至沸腾,出现红色沉淀
C. 将H2C2O4溶液滴入酸性KMnO4溶液中,溶液紫红色褪去
D. 将SO2滴入盛有酚酞的NaOH溶液中,溶液红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在日常生活和生产中有着重要的应用。下列说法不正确的是( )
A. 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为溶液中的SO32—水解
C. 将饱和FeCl3溶液滴入沸水中可制备Fe(OH)3胶体,利用的是盐类水解原理
D. 纯碱溶液呈碱性的原因是CO32—+H2O![]() HCO3—+OH-
HCO3—+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的不可能是
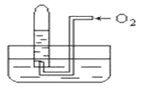
A.NO2一种气体B.O2与NO2的混和气体
C.NO与NO2的混和气体D.N2与NO2的混和气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从3 min到9 min,υ(CO2)=______mol·L-1·min-1
(2)能说明上述反应达到平衡状态的是____________(填编号)
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的压强不随时间的变化而变化
C.单位时间内生成1 mol H2,同时生成1 mol CH3OH
D.混合气体的平均相对分子质量不随时间的变化而变化
(3)平衡时CO2的转化率为________%
(4)平衡混合气体中CO2(g)和H2(g)的质量之比是____________。
(5)第3 min时υ正(CH3OH)___________第9 min时υ逆(CH3OH)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,不合理的是( )

A. 用a趁热过滤提纯苯甲酸B. 用b制备并检验乙烯
C. 用c除去溴苯中的苯D. 用d分离硝基苯与水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com