
【题目】某原电池,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是

A.a为负极,是铁片,烧杯中的溶液为硫酸
B.a为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C.a为正极,是碳棒,烧杯中的溶液为硫酸
D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】瑞巴匹特为新型抗溃疡药,它可保护胃肠黏膜免受各种致溃疡因子的危害,其合成路线如下:

(1)A的化学名称为________,A与足量的NaOH溶液反应的化学方程式________。
(2)化合物D中含氧官能团的名称为________。
(3)反应①~④中,属于取代反应的是________(填序号)。
(4)C→D的转化中,生成的另一种产物为HCl,则X的结构简式为________。
(5)已知Y中的溴原子被-OH取代得到Z,写出同时满足下列条件的Z的一种同分异构体的结构简式:________。
Ⅰ.分子中含有一个苯环和一个五元环,且都是碳原子形成环;
Ⅱ.苯环上有两个取代基,且处于对位;
Ⅲ.能与NaHCO3溶液发生反应。
(6)已知:①CH3CH2OH![]() CH3CH2Br,请写出以A和HOCH2CH2CH2OH为原料制备
CH3CH2Br,请写出以A和HOCH2CH2CH2OH为原料制备![]() 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:___
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的恒容密闭容器中发生反应xA (g) +yB (g) ![]() zC (g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n (A): n (B)的变化关系则下列结论正确的是
zC (g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n (A): n (B)的变化关系则下列结论正确的是

A. 200℃时,反应从开始到平衡的平均速率v(B)=0.04 molL-1min-1
B. 图Ⅱ所知反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
C. 若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v正>v逆
D. 200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法符合事实的是
A.物质的量浓度相同的硫酸氢铵溶液和醋酸铵溶液中,硫酸氢铵中的铵根离子物质的量浓度较小
B.在10mL 0.1 mol/L的AgNO3溶液中加入6mL等浓度的NaCl溶液,有白色沉淀产生,再加入6 mL等浓度的Na2S溶液,溶液中又有黑色沉淀生成,说明Ksp(Ag2S)< Ksp(AgCl)
C.物质的量浓度均为0.02 mol/L的弱酸HX及其盐NaX等体积混合后:c(X-)+ c(HX)=" 0.02" mol/L
D.己知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12。在含C1-、CrO42-浓度相同的溶液中滴加AgNO3溶液时,首先生成Ag2CrO4沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、氯、铜及其化合物在生产、生活中有广泛的用途。试回答下列问题。
(1)二氧化氯(ClO2)已逐步代替Cl2用于自来水处理,用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-)。已知:25 ℃时Ka(HClO)=3.2×10-8,Ka(HClO2)=1.0×10-2,则酸性HClO2________HClO(填“>”“=”或“<”);在pH=5的上述处理过的饮用水中![]() =___________;若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2+将ClO2-还原成Cl-,写出酸性条件下该反应的离子方程式:____________________________________________________________。
=___________;若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2+将ClO2-还原成Cl-,写出酸性条件下该反应的离子方程式:____________________________________________________________。
(2)①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1 mol·L-1,下图为金属离子的浓度的对数与溶液pH的关系,现向混合溶液中通入氨气调节溶液的pH=5.6,溶液中存在的金属阳离子为____________(当溶液中金属离子浓度≤10-5mol·L-1时,可认为沉淀完全)。

②从图中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2]=______________________。
(3)Na2S是常用的重金属离子沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+,滴加Na2S溶液后首先析出的沉淀是________________;当最后一种离子沉淀完全时(该离子浓度为10-5 mol·L-1),此时的S2-浓度为___________________________。已知:Ksp(FeS)=6.3×10-18;Ksp(CuS)=6×10-36;Ksp(PbS)=2.4×10-18。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在A+B=3C+4D的反应中,下列表示该反应的化学反应速度最快的是
A.V(A)=0.5mol/(L·s)B.V(B)=0.3mol/(L·s)
C.V(C)=0.8mol/(L·s)D.V(D)=1mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1molN2和3molH2,在一定条件下发生反应N2+3H2![]() 2NH3。下列有关说法正确的是:
2NH3。下列有关说法正确的是:
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
C.达到化学平衡时,反应则停止进行
D.达到化学平衡时,N2和H2生成速率比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
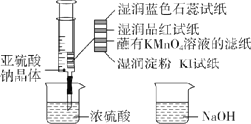
A.蓝色石蕊试纸先变红后褪色
B.NaOH溶液可用于除去实验中多余的SO2
C.湿润淀粉-KI试纸未变蓝说明SO2的氧化性强于I2
D.品红试纸、蘸有KMnO4溶液的滤纸褪色都体现了SO2的漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以芳香烃A为原料合成有机物F和I的合成路线如下:

(1)A的分子式为__________,C中的官能团名称为________________。
(2)D分子中最多有______个原子共平面。
(3)E生成F的反应类型为___________,G的结构简式为__________。
(4)由H生成I的化学方程式为______________。
(5)符合下列条件的B的同分异构体有_______种(不考虑立体异构),其中核磁共振氢谱为4组峰,且面积比为6:2:1:1的是________(写出其中一种的结构简式)。
①属于芳香化合物; ②能发生银镜反应。
(6)已知![]() ,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备
,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备![]() 的合成路线________________。
的合成路线________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com