
【题目】瑞巴匹特为新型抗溃疡药,它可保护胃肠黏膜免受各种致溃疡因子的危害,其合成路线如下:

(1)A的化学名称为________,A与足量的NaOH溶液反应的化学方程式________。
(2)化合物D中含氧官能团的名称为________。
(3)反应①~④中,属于取代反应的是________(填序号)。
(4)C→D的转化中,生成的另一种产物为HCl,则X的结构简式为________。
(5)已知Y中的溴原子被-OH取代得到Z,写出同时满足下列条件的Z的一种同分异构体的结构简式:________。
Ⅰ.分子中含有一个苯环和一个五元环,且都是碳原子形成环;
Ⅱ.苯环上有两个取代基,且处于对位;
Ⅲ.能与NaHCO3溶液发生反应。
(6)已知:①CH3CH2OH![]() CH3CH2Br,请写出以A和HOCH2CH2CH2OH为原料制备
CH3CH2Br,请写出以A和HOCH2CH2CH2OH为原料制备![]() 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:___
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:___
【答案】丙二酸二乙酯 C2H5OOCCH2COOC2H5+2NaOH![]() NaOOCCH2COONa+2C2H5OH 肽键、酯基 ①③④
NaOOCCH2COONa+2C2H5OH 肽键、酯基 ①③④ ![]()


【解析】
由题给有机物的转化关系可知,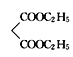 与亚硝酸钠发生取代反应生成
与亚硝酸钠发生取代反应生成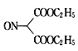 ,
,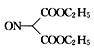 发生还原反应生成
发生还原反应生成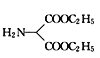 ,
, 与
与![]() 发生取代反应生成
发生取代反应生成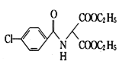 ,
, 与
与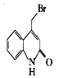 发生取代反应生成
发生取代反应生成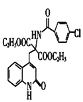 ,
,  与氢氧化钾水溶液反应,酸化得到
与氢氧化钾水溶液反应,酸化得到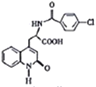 。
。
(1)有机物A的结构简式为![]() ,该物质属于酯类,名称为丙二酸二乙酯;
,该物质属于酯类,名称为丙二酸二乙酯;
酯可在NaOH溶液中发生碱性水解,丙二酸二乙酯与足量NaOH溶液反应生成丙二酸钠和乙醇,反应的化学方程式为![]() +2NaOH
+2NaOH![]() NaOOCCH2COONa+2C2H5OH,故答案为:丙二酸二乙酯;
NaOOCCH2COONa+2C2H5OH,故答案为:丙二酸二乙酯;![]() +2NaOH
+2NaOH![]() NaOOCCH2COONa+2C2H5OH;
NaOOCCH2COONa+2C2H5OH;
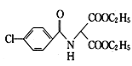
(2)化合物D的结构简式为 ,官能团为氯原子、肽键和酯基,含氧官能团为肽键和酯基,故答案为:肽键和酯基;
,官能团为氯原子、肽键和酯基,含氧官能团为肽键和酯基,故答案为:肽键和酯基;
(3)反应①为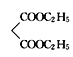 与亚硝酸钠发生取代反应生成
与亚硝酸钠发生取代反应生成 ,反应②为
,反应②为 发生还原反应生成
发生还原反应生成 ,反应③为
,反应③为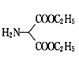 与
与![]() 发生取代反应生成
发生取代反应生成 ,反应④为
,反应④为 与
与 发生取代反应生成
发生取代反应生成 ,属于取代反应的为①③④,故答案为:①③④;
,属于取代反应的为①③④,故答案为:①③④;
(4)C→D的反应为 与
与![]() 发生取代反应生成
发生取代反应生成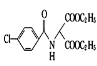 和氯化氢,则X为
和氯化氢,则X为![]() ,故答案为:
,故答案为:![]() ;
;
(5) 中的溴原子被-OH取代得到
中的溴原子被-OH取代得到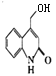 ,
, 的同分异构体能与NaHCO3溶液发生反应,说明含有羧基,分子中含有一个苯环和一个五元环,且都是碳原子形成环,苯环上有两个处于对位的取代基,则Z的一种同分异构体的结构简式为
的同分异构体能与NaHCO3溶液发生反应,说明含有羧基,分子中含有一个苯环和一个五元环,且都是碳原子形成环,苯环上有两个处于对位的取代基,则Z的一种同分异构体的结构简式为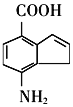 ,故答案为:
,故答案为: ;
;
(6)由题给信息可知,一定条件下,HOCH2CH2CH2OH与HBr发生取代反应生成BrCH2CH2CH2Br,仿D→E→F,BrCH2CH2CH2Br在乙醇钠作用下,与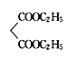 发生取代反应生成
发生取代反应生成![]() ,
,![]() 与氢氧化钾水溶液反应,酸化得到
与氢氧化钾水溶液反应,酸化得到![]() ,合成路线如下:
,合成路线如下:
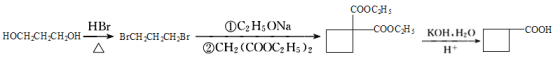 ,故答案为:
,故答案为:
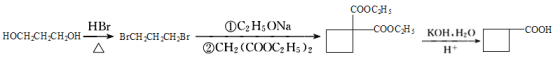 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温时,1mol/L的HA和1mol/L的HB两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,所得变化关系如图所示(V表示溶液稀释后的体积)。下列说法错误的是

A. Ka( HA)约为10-4
B. 当两溶液均稀释至![]() 时,溶液中
时,溶液中![]() >
>![]()
C. 中和等体积pH相同的两种酸所用n(NaOH):HA>HB
D. 等体积、等物质的量浓度的NaA和NaB溶液中离子总数前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的

A. 用溴水能鉴别CH3CH==CHCH2OH和CH3CH2CH2CHO
B. 用如图所示方法可保护钢闸门不被腐蚀
C. 根据核磁共振氢谱不能鉴别1溴丙烷和2溴丙烷
D. 食用花生油和鸡蛋清都能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中钌(Ru)与铁相邻位于铁的下一周期,某钌光敏太阳能电池的工作原理如下图所示,图中RuII*表示激发态。下列说法正确的是( )

A. 电池工作时,直接将太阳能转化为电能
B. 镀铂导电玻璃的作用是传递I-
C. 电池的电解质溶液中I- 和I3-的浓度不断减小
D. 电解质溶液中发生反应:2Ru3+ + 3I-= 2Ru2+ + I3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠广泛用于工业、建筑业及食品加工业。某课外活动小组的同学拟制备亚硝酸钠、测定其产品的纯度并验证亚硝酸钠的某些性质。
(1)甲组同学采用下图装置制取亚硝酸钠。

①仪器M的名称是______________。
②装置A中用较浓的硫酸而不用稀硫酸的原因是_____________________。
③若装置B中生成等物质的量的NO与NO2,则装置B中发生反应的离子方程式为______。
④已知NO与NaOH溶液不反应,而NO2可与NaOH溶液发生反应:2NO2+2NaOH ![]() NaNO3+NaNO2+H2O。若通入装置C中的NO与NO2物质的量之比为1 :1,则装置C中发生反应的化学方程式为_______。
NaNO3+NaNO2+H2O。若通入装置C中的NO与NO2物质的量之比为1 :1,则装置C中发生反应的化学方程式为_______。
(2)乙组同学拟测定甲组制得的产品中NaNO2的纯度。乙组同学采用高锰酸钾滴定法,称取m g试样于锥形瓶中,加入适量水溶解,然后用c mol·L-1的KMnO4溶液(适量稀H2SO4酸化)进行滴定,并重复上述操作2次。
①高锰酸钾溶液应盛放在___________(填“酸式”或“碱式”)滴定管中。
②滴定至终点时溶液的颜色变化是__________________。
③若滴定至终点时平均消耗VmL标准溶液,则产品的纯度为_____(用含c、m、V的代数式表示)。
(3)丙组同学拟设计实验证明:
①酸性条件下NaNO2具有氧化性。实验操作为________________________。
②HNO2的酸性比CH3COOH强。实验操作为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧杯中装有50mLH2SO4和 Na2SO4 的混合液,其浓度分别为 0.16mol/L 和 2mol/L,欲使其浓度分别变为 1.6mol/L 和 0.2mol/L,在只有蒸馏水和 18mol/L 浓H2SO4以及必要仪器的条件下,完成任务:
(1)如图所示仪器,配制上述溶液不需用到的是_____(填字母).配制过程中还缺少的玻璃仪器是_____(填仪器名称)

(2)下列操作可能引起所配溶液浓度偏高的有_____
A.容量瓶中原来存有少量蒸馏水
B.定容时,俯视观察刻度线
C.将量筒洗涤 2﹣3 次,并将洗涤液全部转移至容量瓶中
D.没有用蒸馏水洗烧杯 2﹣3 次,并将洗液移入容量瓶中
(3)实验操作过程中,应量取______mL18molL﹣1的浓 H 2SO4溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄色超氧化钾(KO2)可作为宇宙飞船舱的氧源。某学习小组设计以下实验探究KO2的性质,请回答相关问题:
I.探究KO2与水的反应
实验操作 | 现象 | 结论与解释 |
(1)取少量KO2固体于试管中,滴加少量水,将带火星的木条靠近试管口,反应结束后,溶液分成两份 | 快速产生气泡,木条复燃 | 产生的气体是______ |
(2)一份滴加酚酞试液 | 先变红后褪色 | 可能的产物是______ |
(3)另一份滴加FeCl3溶液 | 观察到______ |
II. 探究KO2与SO2的反应

(4)正确的操作依次是___________________。
①打开K1通入N2 ,排尽装置内原气体后关闭
②拆卸装置至实验完成
③检查装置气密性,然后装入药品
④打开分液漏斗活塞K2
(5)A装置发生的化学方程式为____________________。
(6)用上述装置验证“KO2与SO2反应生成O2”还存在不足,你的改进措施是_____。
(7)改进后再实验,待KO2完全反应后,将装置C中固体加水溶解,配成50.00mL溶液,等分为M、N两份。
①向M溶液中加入足量的盐酸酸化的BaCl2溶液,充分反应后,将沉淀过滤、洗涤、__,称重为2.33g。
②将N溶液移入_______(填仪器名称)中,用0.40mol/L酸性KMnO4溶液滴定,终点时消耗酸性KMnO4溶液20.00mL。
③依据上述现象和数据,请写出该实验总反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是( )
A. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) B. c(H+)+c(NH4+)>c(OH-)+c(HCO3-)+2c(CO32-)
C. c(Cl-)>c(HCO3-)>c(NH4+)>c(CO32-) D. ![]() <1.0×10-7mol/L
<1.0×10-7mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是

A.a为负极,是铁片,烧杯中的溶液为硫酸
B.a为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C.a为正极,是碳棒,烧杯中的溶液为硫酸
D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com