
����Ŀ���ձ���װ��50mLH2SO4�� Na2SO4 �Ļ��Һ����Ũ�ȷֱ�Ϊ 0.16mol/L �� 2mol/L����ʹ��Ũ�ȷֱ��Ϊ 1.6mol/L �� 0.2mol/L����ֻ������ˮ�� 18mol/L ŨH2SO4�Լ���Ҫ�����������£��������
��1����ͼ��ʾ����������������Һ�����õ�����_____������ĸ�������ƹ����л�ȱ�ٵIJ���������_____�����������ƣ�

��2�����в�����������������ҺŨ��ƫ�ߵ���_____
A������ƿ��ԭ��������������ˮ
B������ʱ�����ӹ۲�̶���
C������Ͳϴ�� 2��3 �Σ�����ϴ��Һȫ��ת��������ƿ��
D��û��������ˮϴ�ձ� 2��3 �Σ�����ϴҺ��������ƿ��
��3��ʵ����������У�Ӧ��ȡ______mL18molL��1��Ũ H 2SO4��Һ.
���𰸡�C 500mL����ƿ BC 44
��������
�ձ���װ��50mLH2SO4�� Na2SO4 �Ļ��Һ����ʹ��Na2SO4Ũ����2mol/L��Ϊ0.2mol/L����Һ���Ӧ�ñ�Ϊ![]() =500mL��H2SO4��Ũ����0.16mol/L����Ϊ1.6mol/L�����Ũ��������ʵ�����0.5L��1.6mol/L��0.05L��0.16mol/L=0.792mol������Ҫ������������һ�������Ũ���ᣬ�ټ�������ˮϡ�͵�500mL��
=500mL��H2SO4��Ũ����0.16mol/L����Ϊ1.6mol/L�����Ũ��������ʵ�����0.5L��1.6mol/L��0.05L��0.16mol/L=0.792mol������Ҫ������������һ�������Ũ���ᣬ�ټ�������ˮϡ�͵�500mL��
��1��Ҫ������������һ�������Ũ���ᣬ�ټ�������ˮϡ�͵�500mL����Ҫ���������ձ�������������Ͳ��500 mL����ƿ����ͷ�ιܣ���ͼ��ʾ�������в����õ����Ƿ�Һ©����ѡC�����ƹ����л�ȱ�ٵIJ���������500 mL����ƿ��
��2��A������ƿ��ԭ��������������ˮ����������ҺŨ����Ӱ�죬�ʲ�ѡA��
B������ʱ�����ӹ۲�̶��ߣ���Һ���ƫС��������ҺŨ��ƫ�ߣ���ѡB��
C������Ͳϴ�� 2��3 �Σ�����ϴ��Һȫ��ת��������ƿ�У��������ʵ���ƫ�࣬������ҺŨ��ƫ�ߣ���ѡC��
D��û��������ˮϴ�ձ� 2��3 �Σ�����ϴҺ��������ƿ�У��������ʵ���ƫ�٣�������ҺŨ��ƫС���ʲ�ѡD��
��3�����Ũ��������ʵ�����0.5L��1.6mol/L��0.05L��0.16mol/L=0.792mol����Ũ����������![]() 0.044L=44 mL��ʵ����������У�Ӧ��ȡ44 mL18molL��1��Ũ H2SO4��Һ��
0.044L=44 mL��ʵ����������У�Ӧ��ȡ44 mL18molL��1��Ũ H2SO4��Һ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������·�����Ӧ3A(g)+2B(g) ![]() zC(g)+2D(g)����2 L ���ܱ������а�4 mol A �� 2 mol B ��ϣ�2 min ��Ӧ�ﵽƽ��ʱ���� 1.6 mol C���ֲ�÷�Ӧ����v(D)=0.2 mol��(L��min) -1 ��������˵������ȷ����
zC(g)+2D(g)����2 L ���ܱ������а�4 mol A �� 2 mol B ��ϣ�2 min ��Ӧ�ﵽƽ��ʱ���� 1.6 mol C���ֲ�÷�Ӧ����v(D)=0.2 mol��(L��min) -1 ��������˵������ȷ����
A. z=4 B. B ��ת������40%
C. A ��ƽ��Ũ����1.4 mol��L-1 D. ƽ��ʱ����ѹǿ��ԭ��ѹǿ��0.9
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����0.1 mol/L��NH4HCO3��Һ��pH =7.8����֪��������̼�������ķֲ�������ƽ��ʱij������Ũ��ռ������Ũ��֮�͵ķ�������pH�Ĺ�ϵ����ͼ��ʾ������˵������ȷ����

A. ������Kb(NH3��H2O)> Kal(H2CO3)
B. ��pH =6.5��������Һ����εμ�NaOH��Һʱ��NH4+��HCO3һŨ�ȶ���С
C. NH4HCO3��Һ�д��������غ��ϵ��c( NH4+) +c( NH3��H2O) =c(HCO3-)+c��CO3 2-��+c( H2 CO3)
D. ����Һ��pH =9ʱ����Һ�д������й�ϵ��c(HCO3-)>c(NH4+>c(NH3��H2O)>c��CO3 2-��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ϳ���AG��ʾ��Һ�е����ȣ�AG��lg![]() ��25��ʱ����0.100 mol��L��1��NaOH��Һ�ζ�20��0 mL 0.100 mol��L��1ij�ᣨHA����Һ��AG������NaOH��Һ�������V����ϵ��ͼ��ʾ������˵����ȷ����
��25��ʱ����0.100 mol��L��1��NaOH��Һ�ζ�20��0 mL 0.100 mol��L��1ij�ᣨHA����Һ��AG������NaOH��Һ�������V����ϵ��ͼ��ʾ������˵����ȷ����
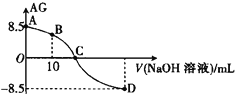
A. B����Һ�д���2c��H������2c��OH������c��A������c��HA��
B. C��ʱ������NaOH��Һ���������20��00 mL
C. �ζ�������Ӧ��ѡ�������ָʾ��
D. 25��ʱ������HA�ĵ���ƽ�ⳣ��Ka��1��0��10��5.5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ƥ��Ϊ���Ϳ�����ҩ�����ɱ���θ���Ĥ���ܸ������������ӵ�Σ������ϳ�·�����£�

��1��A�Ļ�ѧ����Ϊ________��A��������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ________��
��2��������D�к��������ŵ�����Ϊ________��
��3����Ӧ�١����У�����ȡ����Ӧ����________������ţ���
��4��C��D��ת���У����ɵ���һ�ֲ���ΪHCl����X�Ľṹ��ʽΪ________��
��5����֪Y�е���ԭ�ӱ���OHȡ���õ�Z��д��ͬʱ��������������Z��һ��ͬ���칹��Ľṹ��ʽ��________��
�����к���һ��������һ����Ԫ�����Ҷ���̼ԭ���γɻ���
������������ȡ�������Ҵ��ڶ�λ��
������NaHCO3��Һ������Ӧ��
��6����֪����CH3CH2OH![]() CH3CH2Br����д����A��HOCH2CH2CH2OHΪԭ���Ʊ�
CH3CH2Br����д����A��HOCH2CH2CH2OHΪԭ���Ʊ�![]() �ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�___
�ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�___
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ѧУʵ���Ҵӻ�ѧ�Լ��̵���ص������Լ���ǩ�ϵIJ������ݡ� �ݴ�����˵����ȷ���ǣ� ��

A.�������Լ������ʵ���Ũ��Ϊ18.4 mol/L
B.ϡ������ʱӦ��ˮ���������У��ߵ��߽���
C.��״����2.7 g Al�������ĸ����ᷴӦ�ɵõ�H2 3.36 L
D.50 mL��H2SO4�м���������ͭƬ�����ȣ�����ԭ��H2SO4�����ʵ���Ϊ0.46 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��PbCO3���������ᡢ�մɺͲ����ȹ�ҵ���ɷ�Ǧ��(��Ҫ�ɷ�ΪPbS����������FeS��)�����̿�(��Ҫ�ɷ�ΪMnO2)�Ʊ�PbCO3���������£�

��֪��PbCl2��������ˮ���Ҵ�����������ˮ�������ʵ��ܶȻ����±����Իش��������⣺
���� | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | PbCl2 | PbS | PbCO3 |
Ksp | 2��10-13 | 8.0��10-16 | 1��10-38 | 1.6��10-5 | 8.0��10-28 | 7.4��10-14 |
(1)PbCO3��������________��
(2)�������MnO2��������________��������ͼ�����ٵ���ѷ�Ӧ������________��

(3)����ڳ��ȳ��˵�ԭ����___________________��
(4)�����ϴ���õ��Լ���____________��
(5)����ҺY���ữ��Ȼ�����MnO2����Ӧ�����ӷ���ʽΪ__________������Ӧ��c(Mn2+)=0.2mol/L����һ��������Һ��pH�ɷ���Fe3+��Mn2+����Һ������pH��ΧΪ_______[c(Fe3+)��1��10-5 mol/Lʱ��ʾFe3+�ѳ�����ȫ]��
(6)����ܷ�Ӧ�����ӷ���ʽΪ______________��
(7)��ƷPbCO3��������PbCl2���ʣ��ᴿ��ʵ�鷽����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.1 mol��L��1��ij��Ԫ��H2A��Һ�У����ܴ��ڵĺ�A����(H2A��HA����A2��)�����ʵ���������pH�仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����(����)

A. H2A�ĵ��뷽��ʽ��H2A![]() H����HA��
H����HA��
B. pH��5ʱ,��NaHA��Na2A�Ļ����Һ��:c(HA��):c(A2��)��1:100
C. �����ʵ���Ũ�ȵ�NaHA��Na2A��Һ�������ϣ� ����Ũ�ȴ�С��ϵΪ��c(Na��)>c(HA��)>c(A2��)
D. Na2A��Һ�ش���c(OH��)��c(H��)��c(HA��)�� 2c(H2A)��������Ũ�Ⱦ�����0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A+B=3C+4D�ķ�Ӧ��,���б�ʾ�÷�Ӧ�Ļ�ѧ��Ӧ�ٶ�������
A.V(A)=0.5mol/(L��s)B.V(B)=0.3mol/(L��s)
C.V(C)=0.8mol/(L��s)D.V(D)=1mol/(L��s)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com