
����Ŀ����ѧ�ϳ���AG��ʾ��Һ�е����ȣ�AG��lg![]() ��25��ʱ����0.100 mol��L��1��NaOH��Һ�ζ�20��0 mL 0.100 mol��L��1ij�ᣨHA����Һ��AG������NaOH��Һ�������V����ϵ��ͼ��ʾ������˵����ȷ����
��25��ʱ����0.100 mol��L��1��NaOH��Һ�ζ�20��0 mL 0.100 mol��L��1ij�ᣨHA����Һ��AG������NaOH��Һ�������V����ϵ��ͼ��ʾ������˵����ȷ����
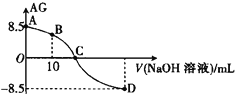
A. B����Һ�д���2c��H������2c��OH������c��A������c��HA��
B. C��ʱ������NaOH��Һ���������20��00 mL
C. �ζ�������Ӧ��ѡ�������ָʾ��
D. 25��ʱ������HA�ĵ���ƽ�ⳣ��Ka��1��0��10��5.5
���𰸡�A
��������
��ͼ��֪��A��lg![]() =8.5����Kw=1.0��10-14�ɵ�c2��H+��=1.0��10-5.5��c��H������0.100 mol��L��1����HAΪ���B��Ϊ��Ũ�ȵ�HA��NaA�����Һ����Һ�����ԣ�C��ʱc��H����=c��OH��������Һ�����ԣ�ΪHA��NaA�����Һ����HA��Һ��ȫ��Ӧʱ������NaOH��Һ�����Ϊ20��00 mL��
=8.5����Kw=1.0��10-14�ɵ�c2��H+��=1.0��10-5.5��c��H������0.100 mol��L��1����HAΪ���B��Ϊ��Ũ�ȵ�HA��NaA�����Һ����Һ�����ԣ�C��ʱc��H����=c��OH��������Һ�����ԣ�ΪHA��NaA�����Һ����HA��Һ��ȫ��Ӧʱ������NaOH��Һ�����Ϊ20��00 mL��
A���ͼ��֪��B��Ϊ��Ũ�ȵ�HA��NaA�����Һ����Һ�����ԣ���Һ�д��ڵ���غ��ϵc��H+��+c��Na+��=c��OH-��+c��A-���������غ��ϵ2c��Na+��=c��HA��+c��A-��������ʽ�ϲ��ɵ�2c��H+��-2c��OH-��=c��A-��-c��HA������A��ȷ��
B���ͼ��֪��C��ʱc��H����=c��OH��������Һ�����ԣ�ΪHA��NaA�����Һ��HAδ��ȫ��Ӧ�������NaOH��Һ�����С��20��00 mL����B������
C�ǿ�������ʱ����Ӧ����ǿ�������Σ������ȫ��Ӧʱ��Һ�Լ��ԣ�Ӧѡ���̪��ָʾ������C����
D���ͼ��֪��A��lg![]() =8.5����Kw=1.0��10-14�ɵ�c2��H+��=1.0��10-5.5��c��H����=
=8.5����Kw=1.0��10-14�ɵ�c2��H+��=1.0��10-5.5��c��H����=![]() ��HA�ĵ��볣��Ka=
��HA�ĵ��볣��Ka=![]() =
=![]() =1��10-4.5����D����
=1��10-4.5����D����
��ѡA��


 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij������ȼ�ϵ������ԭ����ͼ��ʾ�������йظõ�ص�˵���У���ȷ����
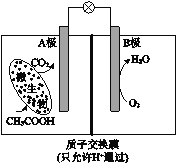
A�����·���Ӵ�B������A��
B����Һ��H+��B��������A����
C����ع���һ��ʱ���B������Һ��pH��С
D��A���缫��ӦʽΪ��CH3COOH - 8e��+2H2O=2CO2 +8H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ����٤����������ֵ������˵������ȷ����
��0.5mol O3��11.2L O2�����ķ�����һ�����
�ڱ�״���£�28g CO��N2�Ļ����������ԼΪ22.4L
��ͨ��״���£�NA��CO2����ռ�е����Ϊ22.4L
�ܳ��³�ѹ�£�92g��NO2��N2O4������庬�е�ԭ����Ϊ6NA
�ݳ����£�4.4g��CO2��N2O������Ӧ��������������еĵ�����Ϊ2.2NA
�ޱ�״���£�22.4LH2O���еķ�����ΪNA
���ڳ��³�ѹ�£�1molO2���е�ԭ����Ϊ2NA
A.�٢ڢۢ�B.�ڢܢݢ�C.�٢ۢݢ�D.�ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ����зḻ��ͭ����Դ����ش������й�ͭ���仯��������⣺
(1)��д����̬Cuԭ�ӵļ۵����Ų�ʽ_________������е���ɫ��ͭ����ɫ����̬ͭԭ��������ʱ�۵��ӷ�����_________ ����Ϊ����̬��
(2)��ͭ����������ʹ�õĺϽ�֮һ����Ҫ��Zn��Cu��ɡ���һ������Il(Zn)______ Il(Cu)����������������С��������ԭ����___________��
(3)����ũҩ��֬��ͭ���еͲ������ص㣬��ͼ����֬��ͭ�Ľṹ��ʽ��

�����1����֬��ͭ�������ĸ���___________����*��̼ԭ�ӵ��ӻ���ʽΪ_____________��
(4)����ͭ���ڰ�ˮ�γ�![]() 4����ɫ��Һ��
4����ɫ��Һ��
�� ![]() �������ӵ����幹����_______��
�������ӵ����幹����_______��
����![]() ��
��![]() ֮���γɵĻ�ѧ����Ϊ_____���ṩ�µ��ӶԵijɼ�ԭ����_______________________��
֮���γɵĻ�ѧ����Ϊ_____���ṩ�µ��ӶԵijɼ�ԭ����_______________________��
�۰��ķе�_________________������������������������좣�
(5)��ͭ�Ͻ���Ա�ʾΪ![]() ��Ϊ�������������������ܶ�Ϊ8.5
��Ϊ�������������������ܶ�Ϊ8.5![]() �����ı߳�___________��ֻд����ʽ����������
�����ı߳�___________��ֻд����ʽ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ�����(Ru)��������λ��������һ���ڣ�ij�ɹ���̫���ܵ�صĹ���ԭ������ͼ��ʾ��ͼ��RuII*��ʾ����̬������˵����ȷ���ǣ� ��

A. ��ع���ʱ��ֱ�ӽ�̫����ת��Ϊ����
B. �Ʋ����粣���������Ǵ���I��
C. ��صĵ������Һ��I�� ��I3����Ũ�Ȳ��ϼ�С
D. �������Һ�з�����Ӧ��2Ru3+ + 3I��= 2Ru2+ + I3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CH4-CO2�������������Եõ��ϳ�����CO��H2����������������ļ��ž�����Ҫ���塣�ش��������⣺
��1��CH4-CO2��������ӦΪ��CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g)��
2CO(g)+2H2(g)��
��֪��C(s)+2H2(g) = CH4(g) ��H= -76 kJ��mol1
C(s)+O2(g) = CO2(g) ��H= -394 kJ��mol1
2C(s)+ O2(g) =2 CO(g) ��H= -222 kJ��mol1
�ô�������Ӧ����H=______kJ��mol1�����������CH4ƽ��ת���ʵ������ǣ����ţ���______________
A�����µ�ѹ B�����¸�ѹ C�����¸�ѹ D�����µ�ѹ
ij�¶��£������Ϊ2 L�������м���2 mol CH4��1 mol CO2�Լ���������������Ӧ���ﵽƽ��ʱCO2��ת������50%����ƽ�ⳣ��Ϊ___mol2��L2��
��2����Ӧ�д������Ի����̼��Ӧ�����ͣ�ͬʱ���ڵ���̼��Ӧ��ʹ��̼�����١�����������±���
��̼��Ӧ�� CH4(g) | ��̼��Ӧ�� CO2(g)+C(s) | ||
��H/(kJ��mol1) | +75 | +172 | |
���/ (kJ��mol1) | ����X | 33 | 91 |
����Y | 43 | 72 | |
���ϱ��жϣ�����X_______Y�������������������������������ǣ�____________��
�ڷ�Ӧ��������ɡ�ѹǿ����Ӧʱ����ͬ������£�ij��������Ļ�̼�����¶ȵ� �仯��ϵ��ͼ��ʾ�������¶�ʱ�����й��ڻ�̼��Ӧ����̼��Ӧ��ƽ�ⳣ��(K)������(��)��������ȷ����________���ţ���

A��K����K��������
B������������������
C��K������K������
D���������ӵı������������ӵı�����
����һ���¶��£����ij�����ϳ���̼���������ʷ���Ϊ��=k��p(CH4)��[p(CO2)]-0.5(kΪ���ʳ���)����p(CH4)һ��ʱ����ͬp(CO2)�»�̼����ʱ��ı仯������ͼ��ʾ����pa(CO2)��pb(CO2)��pc(CO2)�Ӵ�С��˳��Ϊ____��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ձ���װ��50mLH2SO4�� Na2SO4 �Ļ��Һ����Ũ�ȷֱ�Ϊ 0.16mol/L �� 2mol/L����ʹ��Ũ�ȷֱ��Ϊ 1.6mol/L �� 0.2mol/L����ֻ������ˮ�� 18mol/L ŨH2SO4�Լ���Ҫ�����������£��������
��1����ͼ��ʾ����������������Һ�����õ�����_____������ĸ�������ƹ����л�ȱ�ٵIJ���������_____�����������ƣ�

��2�����в�����������������ҺŨ��ƫ�ߵ���_____
A������ƿ��ԭ��������������ˮ
B������ʱ�����ӹ۲�̶���
C������Ͳϴ�� 2��3 �Σ�����ϴ��Һȫ��ת��������ƿ��
D��û��������ˮϴ�ձ� 2��3 �Σ�����ϴҺ��������ƿ��
��3��ʵ����������У�Ӧ��ȡ______mL18molL��1��Ũ H 2SO4��Һ.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ĸ�����Ĵ�����ʯ֮һ����Ҫ�ɷ�ΪBe3Al2Si6O18����������Cr��Ni��FeԪ�ض����ָ�����ɫ���ش��������⣺
��1����̬Ni2+�ĵ����Ų�ʽΪ_______________����ʯ��Si���ӻ���ʽ��____��
��2���ɼ�Ԫ�ص縺�Բ�ֵԽ��ѧ�������ٷ���Խ�ߣ���±����Al��ɵĻ������У������ٷ�����ߵĻ�������______���ѧʽ����
��3�����ʻ���[Cr(CO)6]�����Ƹߴ��ȸ��ۣ����ķе�Ϊ220����Cr(CO)6�ľ���������______������Cr(CO)6�ɵõ��ߴ��ȸ��ۺ�CO����Ӧ�ƻ�������������Ϊ_________��
��4��������������ʾ��ɫ��d����ķ������йء���������ָ�����ӵ�����ԭ�ӣ����ӣ���һ�����Ӵӽϵ�������d���ԾǨ���ϸ�������d������������(������ʾ)�������������ӵĽṹ����ɡ������йء����жϷ�������[Fe(H2O)63+] _____ ��[Fe(H2O)62+]������>����<������=������������___________________________��
��5����������������ͼ����ʾ��A��ԭ���������Ϊ��(0��0��![]() )�����������B��ԭ���������Ϊ_______________��
)�����������B��ԭ���������Ϊ_______________��

����ͼ����ʾ�����ؿ��ӳ���NiO���γ�������������������Ӻ������Ӿ��������壬��뾶�ֱ�Ϊa pm��b pm��������������ظ������С�ظ��ṹ��Ԫ�ڿռ�ʳ����壬�������ڳ������ڵĿռ�������Ϊ____________���г�����ʽ���ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�з�������ͼ�����( )

A. N2(g)+3H2(g)![]() 2NH3(g) ��H=-Q1kJ��mol-1(Q1>0)
2NH3(g) ��H=-Q1kJ��mol-1(Q1>0)
B. 2SO3(g)![]() 2SO2(g)+O2(g) ��H=+Q2kJ��mol-1(Q2>0)
2SO2(g)+O2(g) ��H=+Q2kJ��mol-1(Q2>0)
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ��H=-Q3kJ��mol-1(Q3>0)
4NO(g)+6H2O(g) ��H=-Q3kJ��mol-1(Q3>0)
D. H2(g)+CO(g)![]() C(s)+H2O(g) ��H=+Q4kJ��mol-1(Q4>0)
C(s)+H2O(g) ��H=+Q4kJ��mol-1(Q4>0)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com