
【题目】NA为阿伏伽德罗常数的数值,下列说法中正确的是
①0.5mol O3与11.2L O2所含的分子数一定相等
②标准状况下,28g CO与N2的混合气体的体积约为22.4L
③通常状况下,NA个CO2分子占有的体积为22.4L
④常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
⑤常温下,4.4g的CO2和N2O(不反应)混合物中所含有的电子数为2.2NA
⑥标准状况下,22.4LH2O含有的分子数为NA
⑦在常温常压下,1molO2含有的原子数为2NA
A.①②③⑦B.②④⑤⑦C.①③⑤⑦D.②③④⑥
【答案】B
【解析】
①非标准状况下,11.2L O2的物质的量不一定是0.5mol,故①错误;
②CO与N2的摩尔质量都是28g/mol,28g CO与N2的混合气体的物质的量是1mol,标准状况下的体积约为22.4L,故②正确;
③NA个CO2分子的物质的量是1mol,标准状况下的体积是22.4L,故③错误;
④NO2和N2O4的最简式都是NO2,92g的NO2和N2O4混合气体含有的原子数![]() 6NA,故④正确;
6NA,故④正确;
⑤CO2和N2O分子中都有22个电子, CO2和N2O的摩尔质量都是44g/mol,4.4g的CO2和N2O(不反应)混合物中所含有的电子数为![]() 2.2NA,故⑤正确;
2.2NA,故⑤正确;
⑥标准状况下H2O是液体,22.4LH2O的物质的量不是1mol,故⑥错误;
⑦1个O2分子含有2个氧原子,1molO2含有的原子数为2NA,故⑦正确;
正确的是②④⑤⑦,选B。


科目:高中化学 来源: 题型:
【题目】六水合高氯酸铜[Cu(ClO4)2·6H2O]是一种易溶于水的蓝色晶体,常用作助燃剂。以食盐等为原料制备高氯酸铜晶体的一种工艺流程如下:
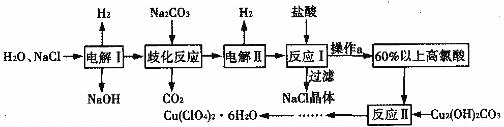
回答下列问题:
(1)Cu2(OH)2CO3在物质类别上属于__________(填序号)。
A.碱 B.盐 C.碱性氧化物
(2)发生“电解I”时所用的是__________(填“阳离子”或“阴离子”)交换膜。
(3)歧化反应是同一种物质中同种元素自身的氧化还原反应,已知上述工艺流程中“歧化反应”的产物之一为NaClO3。该反应的化学方程式为___________________。
(4)“电解II”的阳极产物为____________(填离子符号)。
(5)操作a的名称是______,该流程中可循环利用的物质是____________(填化学式)。
(6)“反应II”的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应3A(g)+2B(g) ![]() zC(g)+2D(g),在2 L 的密闭容器中把4 mol A 和 2 mol B 混合,2 min 后反应达到平衡时生成 1.6 mol C,又测得反应速率v(D)=0.2 mol·(L·min) -1 。则下列说法不正确的是
zC(g)+2D(g),在2 L 的密闭容器中把4 mol A 和 2 mol B 混合,2 min 后反应达到平衡时生成 1.6 mol C,又测得反应速率v(D)=0.2 mol·(L·min) -1 。则下列说法不正确的是
A. z=4 B. B 的转化率是40%
C. A 的平衡浓度是1.4 mol·L-1 D. 平衡时气体压强是原来压强的0.9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,CH3COOH和NH3·H2O的电离常数均为1.8×10-5mol·L-1。向20mL浓度均为0.1mol·L-1 NaOH和NH3·H2O的混合液中滴加等物质的量浓度的CH3COOH溶液,所得混合液的电导率与加入CH3COOH溶液的体积(V)关系如图所示。下列说法错误的是

A. M点:c(Na+)>c(CH3COO-)>c(NH3·H2O)>c(NH4+)
B. 溶液呈中性的点处于N、P之间
C. 已知1g3≈0.5,P点的pH=5
D. P点:3[c(CH3 COO-)+ c(CH3COOH)]=2[ c(Na+)+c(NH4+)+c(NH3·H2O)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积恒为0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数K与t的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数K与t的关系如下表:
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5(mol·L-1)-2 |
请完成下列问题:
(1)试比较K1、K2的大小,K1________K2(填“>”、“=”或“<”)。
(2)下列各项能做为判断该反应达到化学平衡状态的依据的是_____(填字母序号)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v正(N2)=3v逆(H2)
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)400 ℃时,反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数K为____。当测得NH3、H2、N2的物质的量分别为3 mol、1 mol、2 mol时,则该反应的v正(N2)___ v逆(N2)(填“>”、“=”或“<”)。
N2(g)+3H2(g)的平衡常数K为____。当测得NH3、H2、N2的物质的量分别为3 mol、1 mol、2 mol时,则该反应的v正(N2)___ v逆(N2)(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是生活生产中常见的物质,表中列出了它们的(主要)成分
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
名称 | 酒精 | 醋酸 | 火碱 | 食盐 | 铜导线 | 亚硫酸酐 | 苏打 |
主要成分 | CH3CH2OH | CH3COOH | NaOH | NaCl | Cu | SO2 | Na2CO3 |
(1)请你对表中①~⑦的主要成分进行分类(填编号):
属于电解质的是_______________ ,属于非电解质的是____________________ 。
(2)过量②的水溶液与⑦反应的离子方程式 ________________________________。
(3)已知用金属钠制取氧化钠,可有多种方法:
①4Na + O2=2Na2O; ②4Na + CO2 =2Na2O + C;③2NaNO2 + 6Na =4Na2O + N2↑
在上述三种方法中,最好的是_________ ,原因是___________。
(4)某实验小组通过下列实验探究过氧化钠与水的反应:

①用化学方程式解释使酚酞变红的原因 _______________________________;依据实验现象推测红色褪去的原因是___________________________________。
②加入MnO2反应的化学方程式为 ___________________________________ 。
(5)在实验室模拟侯氏制碱法制备碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。该过程的化学方程式为:____________
(6)在化学课上老师向NaOH溶液通入CO2后无明显现象,那我们如何通过实验证明CO2与NaOH发生了反应?某化学小组同学将过量的干冰放入氢氧化钠溶液中,利用数字化传感器测定溶液pH的变化,如图所示,请用化学方程式回答下列问题:
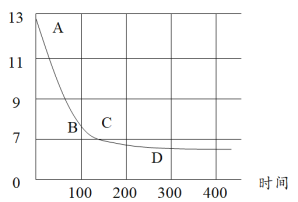
①BC段变化原因可能是 ___________________________________________________________ ;
②CD段变化原因可能是 ___________________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1 mol/L的NH4HCO3溶液,pH =7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是

A. 常温下Kb(NH3·H2O)> Kal(H2CO3)
B. 向pH =6.5的上述溶液中逐滴滴加NaOH溶液时,NH4+和HCO3一浓度都逐渐减小
C. NH4HCO3溶液中存在下列守恒关系:c( NH4+) +c( NH3·H2O) =c(HCO3-)+c(CO3 2-)+c( H2 CO3)
D. 当溶液的pH =9时,溶液中存在下列关系:c(HCO3-)>c(NH4+>c(NH3·H2O)>c(CO3 2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用AG表示溶液中的酸碱度,AG=lg![]() 。25℃时,用0.100 mol·L-1的NaOH溶液滴定20.0 mL 0.100 mol·L-1某酸(HA)溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法正确的是
。25℃时,用0.100 mol·L-1的NaOH溶液滴定20.0 mL 0.100 mol·L-1某酸(HA)溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法正确的是
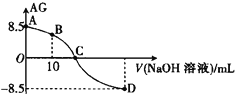
A. B点溶液中存在2c(H+)-2c(OH-)=c(A-)-c(HA)
B. C点时,加入NaOH溶液的体积大于20.00 mL
C. 滴定过程中应该选择甲基橙做指示剂
D. 25℃时,该酸HA的电离平衡常数Ka=1.0×10-5.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol·L-1的某二元酸H2A溶液中,可能存在的含A粒子(H2A、HA-、A2-)的物质的量分数随pH变化的关系如图所示,下列说法正确的是( )

A. H2A的电离方程式:H2A![]() H++HA-
H++HA-
B. pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100
C. 等物质的量浓度的NaHA和Na2A溶液等体积混合, 离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)
D. Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+ 2c(H2A),各粒子浓度均大于0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com