
【题目】在容积恒为0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数K与t的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数K与t的关系如下表:
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5(mol·L-1)-2 |
请完成下列问题:
(1)试比较K1、K2的大小,K1________K2(填“>”、“=”或“<”)。
(2)下列各项能做为判断该反应达到化学平衡状态的依据的是_____(填字母序号)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v正(N2)=3v逆(H2)
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)400 ℃时,反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数K为____。当测得NH3、H2、N2的物质的量分别为3 mol、1 mol、2 mol时,则该反应的v正(N2)___ v逆(N2)(填“>”、“=”或“<”)。
N2(g)+3H2(g)的平衡常数K为____。当测得NH3、H2、N2的物质的量分别为3 mol、1 mol、2 mol时,则该反应的v正(N2)___ v逆(N2)(填“>”、“=”或“<”)。
【答案】(1)> (2)c (3)2 >
【解析】
(1)因反应是放热反应,升温平衡向左移动,反应程度减小,故K1>K2;(2)因反应前后气体总体积发生变化,故压强不变,说明反应混合物中各组分的含量不变,即反应处于平衡状态;反应前后气体质量不变,容器容积不变,故反应过程中混合气体的密度一直保持不变;反应平衡时,3v正(N2)=v逆(H2);容器中N2、H2、NH3的浓度之比与反应是否达到平衡状态无关;(3)在400℃时,合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的化学平衡常数K=0.5,故400℃时,2NH3(g)
2NH3(g)的化学平衡常数K=0.5,故400℃时,2NH3(g)![]() N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为![]() =2;利用容器中各物质的物质的量浓度可知:Q=
=2;利用容器中各物质的物质的量浓度可知:Q=![]() =
=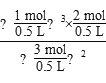 =
=![]() <2,所以反应2 NH3(g)
<2,所以反应2 NH3(g)![]() N2(g)+3H2(g)向右进行,v正(N2)>v逆(N2)
N2(g)+3H2(g)向右进行,v正(N2)>v逆(N2)


科目:高中化学 来源: 题型:
【题目】环丁基甲酸是重要的有机合成中间体,其一种合成路线如下:
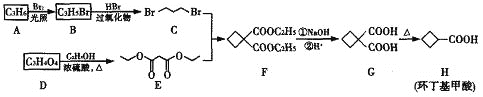
请回答下列问题:
(1)环丁基甲酸的分子式为____________________。
(2)环丁基甲酸由原料A和D经一系列反应制得,A为烯烃,则A的名称为______,D物质的官能团为_______。
(3)写出D→E的化学方程式________________________。
(4)C+E→F的反应类型为_________________________。
(5)化合物W为H的同分异构体,能发生银镜反应且只含酯基一种官能团,则所有符合条件的W的结构简式为_____________。
(6)参照上述合成路线,以 ![]() 和E为原料(无机试剂任选),设计制备
和E为原料(无机试剂任选),设计制备![]() 的合成路线:__________。
的合成路线:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,1mol/L的HA和1mol/L的HB两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,所得变化关系如图所示(V表示溶液稀释后的体积)。下列说法错误的是

A. Ka( HA)约为10-4
B. 当两溶液均稀释至![]() 时,溶液中
时,溶液中![]() >
>![]()
C. 中和等体积pH相同的两种酸所用n(NaOH):HA>HB
D. 等体积、等物质的量浓度的NaA和NaB溶液中离子总数前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中不正确
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中不正确

A. 曲线a表示NO2的物质的量随时间的变化
B. 10 s时,v(正)>v(逆)
C. 20 s时反应达到平衡
D. 0~20 s内平均反应速率 v(O2)=0.05 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应3A(g)+2B(g) ![]() zC(g)+2D(g),在2 L 的密闭容器中把4 mol A 和 2 mol B 混合,2 min 后反应达到平衡时生成 1.6 mol C,又测得反应速率v(D)=0.2 mol·(L·min) -1 。则下列说法不正确的是
zC(g)+2D(g),在2 L 的密闭容器中把4 mol A 和 2 mol B 混合,2 min 后反应达到平衡时生成 1.6 mol C,又测得反应速率v(D)=0.2 mol·(L·min) -1 。则下列说法不正确的是
A. z=4 B. B 的转化率是40%
C. A 的平衡浓度是1.4 mol·L-1 D. 平衡时气体压强是原来压强的0.9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的数值,下列说法中正确的是
①0.5mol O3与11.2L O2所含的分子数一定相等
②标准状况下,28g CO与N2的混合气体的体积约为22.4L
③通常状况下,NA个CO2分子占有的体积为22.4L
④常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
⑤常温下,4.4g的CO2和N2O(不反应)混合物中所含有的电子数为2.2NA
⑥标准状况下,22.4LH2O含有的分子数为NA
⑦在常温常压下,1molO2含有的原子数为2NA
A.①②③⑦B.②④⑤⑦C.①③⑤⑦D.②③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的

A. 用溴水能鉴别CH3CH==CHCH2OH和CH3CH2CH2CHO
B. 用如图所示方法可保护钢闸门不被腐蚀
C. 根据核磁共振氢谱不能鉴别1溴丙烷和2溴丙烷
D. 食用花生油和鸡蛋清都能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中钌(Ru)与铁相邻位于铁的下一周期,某钌光敏太阳能电池的工作原理如下图所示,图中RuII*表示激发态。下列说法正确的是( )

A. 电池工作时,直接将太阳能转化为电能
B. 镀铂导电玻璃的作用是传递I-
C. 电池的电解质溶液中I- 和I3-的浓度不断减小
D. 电解质溶液中发生反应:2Ru3+ + 3I-= 2Ru2+ + I3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是( )
A. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) B. c(H+)+c(NH4+)>c(OH-)+c(HCO3-)+2c(CO32-)
C. c(Cl-)>c(HCO3-)>c(NH4+)>c(CO32-) D. ![]() <1.0×10-7mol/L
<1.0×10-7mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com