
A由Al2O3、Fe3O4、Al、Cu中的某几种粉末混合而成,该混合物成分的分析方案如下图所示。

下列分析错误的是( )
A.当m1>m2时,溶液a中的阴离子只有1种
B.生成蓝色溶液的离子方程式为Cu+2Fe3+===Cu2++2Fe2+
C.要确定混合物中是否含有Al,可取A加入适量稀盐酸
D.当m2-m3=2.96 g时,Fe3O4的质量至少为2.32 g
A
【解析】
试题分析:A、当m1>m2时,说明至少有Al2O3、Al两者中的一种与氢氧化钠溶液反应,且生成了偏铝酸钠溶液,而氢氧化钠是过量的,所以阴离子不只一种,错误;B、m2g的固体与盐酸反应又得固体和蓝色溶液,说明固体中一定有四氧化三铁,Fe3O4与盐酸反应生成氯化铁和氯化亚铁,三价铁离子有强氧化性,发生Cu+2Fe3+═Cu2++2Fe2-,正确;C、金属氧化物与酸反应生成水,无氢气,而铜与盐酸不反应在,可取A加入适量稀盐酸,如果有气体产生,证明铝的存在,正确;D、引起固体质量改变的是四氧化三铁与盐酸的反应,和三价铁与铜单质之间的氧化还原反应,Cu+2Fe3+=Cu2++2Fe2+,Fe3O4~2Fe3+~Cu,也就是当m2-m3=2.96g时四氧化三铁和铜的物质的量大于或等于1:1才符合,最小值为1:1,即反应掉的固体中四氧化三铁的质量至少是2.96g×232/(232+64)×100%=2.32 g,正确,答案选A。
考点:考查常见金属元素及化合物的综合应用


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源:2014-2015学年湖南长沙市高三上学期第二次月考化学试卷(解析版) 题型:选择题
用图中所示的装置进行实验,实验现象与预测不一致的是
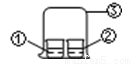
| ①中的物质 | ②中的物质 | 预测现象 |
A | 浓氨水 | FeCl3溶液 | ②中有红褐色沉淀 |
B | 浓氨水 | 浓盐酸 | ③中有白烟 |
C | 浓硝酸 | 淀粉KI溶液 | ②中溶液为蓝色 |
D | 饱和亚硫酸溶液 | 蓝色石蕊试液 | ②中溶液先变红又褪色 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省衡阳市高二上学期期中考试化学试卷(解析版) 题型:选择题
下图是用未知浓度的NaOH溶液来滴定10mL盐酸(标准液)所得的曲线(25℃),则下列说法不正确的是
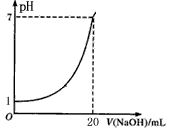
A.标准液盐酸的浓度为0.1 mol/L
B.NaOH溶液的浓度为0.05 mol/L
C.滴定终点时,俯视碱式滴定管读数,所测NaOH溶液浓度会偏高
D.指示剂变色时,说明盐酸与NaOH恰好完全反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省衡阳市高二上学期期中考试化学试卷(解析版) 题型:选择题
向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为
A.减小、增大、减小 B.增大、减小、减小
C.减小、增大、增大 D.增大、减小、增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第二次月考化学试卷(解析版) 题型:实验题
(14分)硫代硫酸钠(Na2S2O3)是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.【查阅资料】
(1)硫代硫酸钠(Na2S2O3)易溶于水,在中性或碱性环境中稳定,受热、遇酸易分解。
(2)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(3)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3(反应方程式为:2Na2S+Na2CO3+ 4SO2===3Na2S2O3+CO2),所得产品常含有少量Na2SO3和Na2SO4。
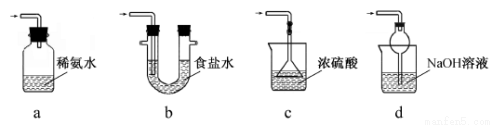
Ⅱ.【制备产品】实验装置如图所示:

请回答下列问题:
(1)实验步骤:检查装置气密性后,向三颈瓶c中加入Na2CO3和Na2S的混合溶液,再将分液漏斗a中液体滴加到烧瓶b中加热发生反应产生SO2,请写出b中发生反应的化学方程式______________________。待Na2S和Na2CO3完全消耗后,结束反应。过滤c中的混合物,滤液经____________________(填写操作名称)、过滤、洗涤、干燥、得到产品。
(2) 装置A用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是____________________。
III.【测定产品纯度】
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O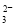 +I2===S4O
+I2===S4O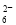 +2I-(忽略Na2SO3与I2反应)
+2I-(忽略Na2SO3与I2反应)
(4)滴定至终点时,溶液颜色的变化:_________________________________。
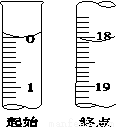
(5)滴定起始和终点的液面位置如图,则产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
IV.【探究与反思】
(6)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_______________________________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是( )
A.Fe(OH)2 B.Fe2O3 C. FeO D.Fe3O4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列反应中,反应后固体物质增重的是( )
A.氨气通过灼热的CuO粉末 B. 将锌粒投入Cu(NO3)2溶液
C.铝与Fe2O3发生铝热反应 D.水蒸气通过Na2O2粉末
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
① ω=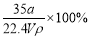 ② c=
② c=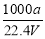
③ 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④ 上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
A.①④B.②③C.①③D.②④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省浏阳市高一上第一次月考试卷化学试卷(解析版) 题型:选择题
下列物质的分离方法不正确的是 ( )
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用淘洗的方法从沙里淘金
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com