
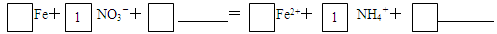
 HCO3-+ OH-增大了溶液的pH会降低脱氮效果;Fe2+ + CO32-= FeCO3↓覆盖在反应物的表面阻止反应进行。
HCO3-+ OH-增大了溶液的pH会降低脱氮效果;Fe2+ + CO32-= FeCO3↓覆盖在反应物的表面阻止反应进行。 Fe(OH)2+2HCl,随着不断加热,水分蒸发。促进盐的水解,由于HCl有挥发性会逸出,所以得到固体Fe(OH)2。而Fe(OH)2不稳定,会被空气中的氧气氧化为Fe(OH)3.在空气中加热灼烧,发生分解反应2Fe(OH)3
Fe(OH)2+2HCl,随着不断加热,水分蒸发。促进盐的水解,由于HCl有挥发性会逸出,所以得到固体Fe(OH)2。而Fe(OH)2不稳定,会被空气中的氧气氧化为Fe(OH)3.在空气中加热灼烧,发生分解反应2Fe(OH)3 Fe2O3+3H2O.因此最终得到的固体是Fe2O3。(4)根据电子守恒、电荷守恒及原子守恒可得将酸性条件下,铁与NO3-反应的离子方程式为:4 Fe + NO3-+ 10H+=4 Fe2+ + NH4+ +3H2O。(5)添加活性炭后,在溶液中C与铁构成了无数个微小的铁碳原电池加快反应速率;此外活性炭吸附生成物NH4+ 、OH-能降低出水中的NH4+的浓度及降低水溶液的pH 值。(6)在正常地下水中含有CO32-。它会发生水解反应: CO32- +H2O
Fe2O3+3H2O.因此最终得到的固体是Fe2O3。(4)根据电子守恒、电荷守恒及原子守恒可得将酸性条件下,铁与NO3-反应的离子方程式为:4 Fe + NO3-+ 10H+=4 Fe2+ + NH4+ +3H2O。(5)添加活性炭后,在溶液中C与铁构成了无数个微小的铁碳原电池加快反应速率;此外活性炭吸附生成物NH4+ 、OH-能降低出水中的NH4+的浓度及降低水溶液的pH 值。(6)在正常地下水中含有CO32-。它会发生水解反应: CO32- +H2O OH-+HCO3-,使溶液显碱性,溶液的pH的增大会降低脱氮效果;此外还会发生沉淀反应:Fe2+ + CO32-= FeCO3↓覆盖在反应物的表面阻止反应进行。
OH-+HCO3-,使溶液显碱性,溶液的pH的增大会降低脱氮效果;此外还会发生沉淀反应:Fe2+ + CO32-= FeCO3↓覆盖在反应物的表面阻止反应进行。

科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
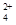 ,该水解反应的离子方程式为________________________________________________________________。
,该水解反应的离子方程式为________________________________________________________________。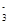 。为检验所得的产品中是否含有Fe2+,应使用的试剂为________。
。为检验所得的产品中是否含有Fe2+,应使用的试剂为________。查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.先滴加氯水,再滴加KSCN溶液后显红色 |
| B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色 |
| C.滴加NaOH溶液,先产生白色沉淀,后变为灰绿色,最后呈红褐色 |
| D.只需滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
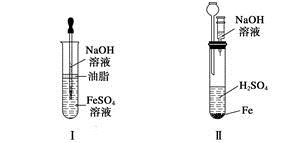
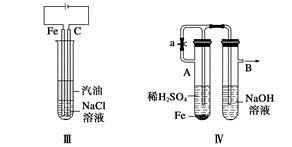
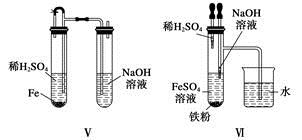
| A.Ⅰ、Ⅱ、Ⅳ |
| B.Ⅰ、Ⅱ、III、Ⅳ、Ⅵ |
| C.Ⅰ、III、Ⅴ |
| D.Ⅰ、Ⅱ、III、Ⅳ、Ⅴ、Ⅵ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.滤液A中的阳离子为Fe3+、Fe2+、H+ |
| B.样品中Fe元素的质量为2.24 g |
| C.样品中CuO的质量为4.0 g |
| D.V=896 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com