
【题目】可用于治疗胃酸过多的物质是
A. 碳酸氢钠 B. 氯化钠 C. 氯化钾 D. 氢氧化钠
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期元素,非金属元素A的最外层电子数与其周期数相等,B的成对电子与未成对电子所占据的原子轨道数相等。单质B在单质C中充分燃烧生成BC2。 D+与C2-具有相同的电子数。A在E中燃烧,产物溶于水会得到一种强酸。
(1)B在元素周期表中的位置是________,写出一种工业制备单质E的化学方程式:_____。
(2)B、C、D组成的一种盐中,B的质量分数为17. 91%,D的质量分数为34. 3 3%。该盐的化学式为________,其阴离子中B原子的杂化方式为__________。
(3)由这些元素组成的某些物质的组成和结构信息如下表:
物质 | 组成和结构 |
a | A、D两元素组成的离子化合物 |
b | 由C、D两元素组成的含有非极性键的离子化合物 |
c | 化学组成为BCE2 |
a的电子式为_________;b的化学式为________;c的空间构型为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关活化分子的说法正确的是( )
A. 增大反应物浓度可以提高活化分子百分数
B. 增大体系的压强一定能提高活化分子百分数
C. 使用合适的催化剂可以增大活化分子的能量
D. 升高温度能提高活化分子百分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①C(s)+O2(g)==CO2(g)△H= —393.5kJ/mol
②CO(g)+ 1/2 O2(g)== CO2(g)△H= —283.0kJ/mol
③2Fe(s)+3CO(g)==Fe2O3(s)+3C(s) △H= —489.0kJ/mol
则4Fe(s)+3O2(g)==2Fe2O3(s)的反应热ΔH为( )
A.-1641.0kJ/mol B.+3081kJ/mol
C.+663.5kJ/mol D.-2507.0kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学式C8H10O的化合物A具有如下性质;①A+Na![]() 慢慢产生气泡 ②A+RCOOH
慢慢产生气泡 ②A+RCOOH![]() 有香味的产物 ③A
有香味的产物 ③A![]() 苯甲酸 ④其催化脱氢产物不能发生银镜反应 ⑤脱水反应的产物,经聚合反应可制得一种塑料制品(它是目前造成“白色污染”的主要污染源之一)。
苯甲酸 ④其催化脱氢产物不能发生银镜反应 ⑤脱水反应的产物,经聚合反应可制得一种塑料制品(它是目前造成“白色污染”的主要污染源之一)。
试回答;
(1)根据上述信息,对该化合物的结构可作出的判断是_____________;
A.苯环上直接连有羟基 B.苯环侧链末端有甲基
C.肯定有醇羟基 D.肯定是芳香烃
(2)化合物A的结构简式_____________;
(3)A和金属钠反应的化学方程式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 电解熔融氯化镁可制取金属镁
B. 电解饱和食盐水可制取氯气
C. 生产普通玻璃的主要原料为石灰石、纯碱和晶体硅
D. 接触法制硫酸的硫元素主要来源于硫黄或含硫矿石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图。反应中镁和铝的 ( )
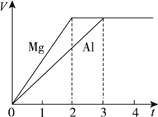
A. 摩尔质量之比为2∶3
B. 物质质量之比为3∶2
C. 物质的量之比为3∶2
D. 物质的量之比为2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】150℃时,向如图所示的容器(密封的隔板可自由滑动)中加入4LN2和H2的混合气体, 在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度。平衡后容器体积变为3.4L,容器内气体对相同条件的氢气的相对密度为5。
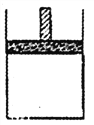
(1)反应前混合气体中V(N2):V(H2)= _______, 反应达到平衡后V(NH3)= _______L,该反应中N2转化率为______。
(2)向平衡后的容器中充入0. 2mol的NH3,一段对间后反应再次达到平衡,恢复到150℃时测得此过程中从外界吸收了 6.44kJ的热量;
①充入NH3时,混合气体的密度将_________,在达到平衡的过程中,混合气体的密度将_______(填“增大”、“减小”或“不变”);反应重新达平衡的混合气体对氢气的相对密度将_____5(填“ >”、“ <”或“=”)。
②下列哪些实验现象或数据能说明反应重新到达了平衡 _______;
A.容器不再与外界发生热交换
B.混合气体的平均相对分子质量保持不变
C.当K( N2):V( H2):F( NH3) = 1:3:2时
D.当容器的体积不再发生变化时
③写出该反应的热化学方程式: __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份100 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:

(1)原NaOH溶液的物质的量浓度为________。
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为________ L。
(3)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是________________,其物质的量之比为________。
(4)曲线B表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是________________,其物质的量之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com