
【题目】已知下列热化学方程式:
①C(s)+O2(g)==CO2(g)△H= —393.5kJ/mol
②CO(g)+ 1/2 O2(g)== CO2(g)△H= —283.0kJ/mol
③2Fe(s)+3CO(g)==Fe2O3(s)+3C(s) △H= —489.0kJ/mol
则4Fe(s)+3O2(g)==2Fe2O3(s)的反应热ΔH为( )
A.-1641.0kJ/mol B.+3081kJ/mol
C.+663.5kJ/mol D.-2507.0kJ/mol
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如图所示的关系图(部分产物、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。

己知:
Ⅰ Ⅱ
Ⅱ
请根据所学知识与本题所给信息回答下列问题:
(1)H的结构简式是________________。
(2)反应②、③的反应类型分别是________________、________________。
(3)反应①的化学方程式是_________________________。反应⑤的化学方程式是___________________。
(4)![]() 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有______种。
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有______种。
(5)请用合成反应流程图表示出由![]() 和其他无机物合成
和其他无机物合成![]() 最合理的方案(不超过4步)。例如:
最合理的方案(不超过4步)。例如:
 ______________________________________________________________________________
______________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质焰色反应均为黄色,它们按图所示关系相互转化.
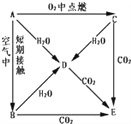
(1)这五种物质中,A: ___________、 C: ___________.
(2)将CO2通入E的饱和溶液中,该反应的离子方程式为______________________________.
(3)写出A→D、C→D、C→E反应的化学方程式
A→D:___________________________.
C→D:___________________________.
C→E:___________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
A. SiO2、NO2均为酸性氧化物 B. 稀豆浆、淀粉溶液均为胶体
C. 烧碱、乙醇均为电解质 D. 水玻璃、冰醋酸均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如下:

已知①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

(1)浸出过程中加入Na2SO3的目的是_____________。
(2)制取NaClO3可以将氯气通入到热的浓氢氧化钠溶液,该反应的离子方程式为__________________ ;实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为_______________ (标准状况)。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。

滤液Ⅱ中加入萃取剂的作用是_________;使用萃取剂适宜的pH是______(填选项序号)。
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。
已知K sp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c(Ca2+)=________________。
(5)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离平衡常数K1 =1.8×10-5mol·L-1H2SO4的电离平衡常数K2=1.2×10-2mol·L-1,K3 =1.3×10-8mol·L-1。在通入废气的过程中:
当恰好形成正盐时,溶液中离子浓度的大小关系为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关晶体的叙述中,不正确的是( )
A. 金刚石网状结构中,由形成的碳原子环中,最小的环上有6个碳原子
B. 12g石墨中含有σ键的个数为2NA (NA表示阿伏伽德罗常数)
C. 氯化铯晶体中,每个CS+周围紧邻8个C1-
D. 干冰晶体中,每个CO2分子周围紧邻12个CO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成正丁醛的实验装置如图所示。

发生的反应如下:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
(正丁醇) (正丁醛)
反应物和产物的相关数据列表如下:
沸点/℃ | 密度(g·cm-3) | 水中溶解性 | |
正丁醇 | 11.72 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中在A中加入4.0g 正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃在F中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g。回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,并说明理由________。
(2)加入沸石的作用是________。若加热后发现未加沸石,应采取的正确方法是________。
(3)上述装置图中,E仪器的名称是________,D仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________(填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在________层(填“上”或“下”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com