
【题目】利用硫铁矿烧渣(主要成分为Fe2O3,还含有少量Al2O3、 MgO、SiO2等杂质)制备铁红工艺流程如下:

回答下列问题:
(1)还原焙烧后,Fe元素的化合价为__________。
(2)“酸浸”实验中,需加入絮凝剂沉淀杂质。絮凝剂用量和过滤时间对铁红成份的影响如下表所示。由表可知,所采用的最佳实验条件为__________。
絮凝剂用量/×10-6t | 过滤时间min | Fe2O3含量% | SiO2含量% |
40 | 5 | 96.5 | 0.12 |
50 | 10 | 97.9 | 0.10 |
60 | 20 | 98.3 | 0.07 |
100 | 40 | 99.4 | 0.01 |
150 | 150 | 99.5 | 0.008 |
(3)若“合成”中c(Mg2+)=0.01mol/L,加入NH4HCO3(设溶液体积增加1倍),当Fe2+恰好沉淀完全时,溶液中c(Fe2+)=1.0×10-5mol/L,此时是否有MgCO3沉淀生成?_______(列式计算)。FeCO3、MgCO3的Ksp分别为3.2×10-11、3.0×10-8。
(4)“合成”过程中发生反应的离子方程式为_____________.
(5)“合成”过程中温度对亚铁离子转化率的影响如下图,分析选择反应温度为40℃的原因是________。

(6)“煅烧”中由FeCO3制备Fe 2O3的化学方程式为___________。
(7)本流程中,铝元素是以________(填化学式)形式被除去的。
【答案】 +2 1.0×10-4t,40min 无沉淀生成,c(CO32-)=Ksp(FeCO3)/c(Fe2+)=3.2×10-11/10-5=3.2×10-6,Q= c(CO32-)×c(Mg2+)=3.2×10-6×0.01/2< Ksp(MgCO3) Fe2++2HCO3-=FeCO3↓+H2O+CO2↑ 温度低于40℃,亚铁离子转化率较低;温度高于40℃,亚铁离子转化率变化不大;温度过高,碳酸氢铵易分解 4FeCO3 +O2 ![]() 2Fe2O3+ 4CO2 Al(OH)3
2Fe2O3+ 4CO2 Al(OH)3
【解析】(1)硫铁矿烧渣中主要成分为Fe2O3,加炭黑还原焙烧,Fe元素的化合价降为+2价。
(2)由表中数据可得虽然絮凝剂用量越多、过滤时间越长,Fe2O3含量越高、SiO2含量越低,但是1.0×10-4t、40min条件与1.5×10-4t、150min条件相比,前者Fe2O3含量只比后者低0.1个百分点,SiO2含量高0.002个百分点,而絮凝剂用量和过滤时间,前者比后者明显少,所以应选择最佳实验条件为:1.0×10-4t、40min。
(3)因为c(CO32-)=Ksp(FeCO3)÷c(Fe2+)=3.2×10-11÷10-5=3.2×10-6,所以Q(MgCO3)=c(CO32-)×c(Mg2+)=3.2×10-6×![]() ×0.01<Ksp(MgCO3)=3.0×10-8,故无MgCO3沉淀生成。
×0.01<Ksp(MgCO3)=3.0×10-8,故无MgCO3沉淀生成。
(4)结合流程并根据题意,向含Fe2+的溶液中加入NH4HCO3,生成了FeCO3沉淀,根据原子守恒和电荷守恒,还应生成H2O和CO2,故“合成”过程中发生反应的离子方程式为:Fe2++2HCO3-=FeCO3↓+H2O+CO2↑。
(5)由图可得,温度低于40℃时,亚铁离子的转化率较低;温度高于40℃,亚铁离子转化率变化不大;而温度过高碳酸氢铵容易分解,所以合成过程中选择反应温度为40℃。
(6)在空气中煅烧FeCO3,FeCO3分解,+2价铁会被氧化成+3价铁的化合物,所以生成物为:Fe2O3和CO2,故“煅烧”中由FeCO3制备Fe2O3的化学方程式为:4FeCO3+O2![]() 2Fe2O3+4CO2。
2Fe2O3+4CO2。
(7)本流程中酸浸时Al2O3转变为Al3+,加NH4HCO3时,Al3+会与HCO3-双水解转变为Al(OH)3,由此可得铝元素是以Al(OH)3形式被除去的。


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】常温下。向20.00mL0.1mol/LHA溶液中滴入0.1mol/LNaOH溶液,溶液中由水电离出的氢离子浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积的关系如图所示,下列说法不正确的是

A. 常温下,Ka(HA)约为10-5
B. M、P两点溶液对应的pH=7
C. b=20.00
D. M点后溶液中均存在c(Na+)>c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的沸点,按由低到高顺序排列的是 ( )
A. NH3、CH4、NaCl、Na
B. H2O、H2S、MgSO4、SO2
C. CH4、H2O、NaCl、SiO2
D. Li、Na、K、Rb、Cs
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、锌及其化合物用途非常广泛。回答下列问题:
(1)基态锌原子的价电子排布式为____________________;锌的第二电离能I2(Zn)小于铜的第二电离能I2(Cu),其原因是____________________________________。
(2)O和S处于同一主族。H2O及H2S中,中心原子的杂化方式相同,键长及键角如图所示。

①H2O分子中的键长比H2S中的键长短,其原因是___________________________。
②H2O分子中的键角∠HOH比H2S分子中的键角∠HSH大,其原因是_________________。
(3)单质硫与热的NaOH浓溶液反应的产物之一为Na2S3。S32-的空间构型为_________,中心原子的杂化方式为_________________。
(4)噻吩( )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。
①噻吩分子中含有_______个σ键,分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则噻吩分子中的大π键应表示为______________。
),则噻吩分子中的大π键应表示为______________。
②噻吩的沸点为84℃,吡咯(![]() )的沸点在129~131℃之间,后者沸点较高,其原因是__________________________________。
)的沸点在129~131℃之间,后者沸点较高,其原因是__________________________________。
(5)硫化锌是一种半导体材料,其晶胞结构如图所示。

①已知A点的原子坐标参数为(0,0,0);B点的原子坐标参数为(![]() ,0,
,0,![]() ),则C点的原子坐标参数为__________。
),则C点的原子坐标参数为__________。
②硫化锌晶体的密度为4.05g·cm-3,晶胞边长为anm,设NA为阿伏加德罗常数的数值,则a=_________(列出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,HCl作氧化剂的是( )
A.NaOH+HCl=NaCl+H2O
B.Zn+2HCl=ZnCl2+H2↑
C.MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.CuO+2HCl=CuCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X元素的1个原子失去2个电子,被Y元素的2个原子各获得1个电子,形成离子化合物Z,下列说法中不正确的是 ( )
A. 固态Z是离子晶体
B. Z可以表示为X2Y
C. 固态Z熔化后能导电
D. X可形成+2价阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述不正确的是( )

A. 铜电极上发生还原反应
B. 电池工作一段时间后,c(SO42-)向锌电极移动,甲池的c(SO42-)增大
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 电流的方向:由铜电极经过导线流向锌电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu、Fe、Se、Co、Si常用于化工材料的合成。请回答下列问题:
(1)铁离子(Fe3+)最外层电子排布式为______,其核外共有______种不同运动状态的电子。Fe3+比Fe2+更稳定的原因是____________________________________。
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的电负性从大到小的顺序为________(用元素符号表示)。
(3)Na3[Co(NO2)6]常用作检验K+的试剂,在[Co(NO2)6]3-中存在的化学键有____、_____。
(4)C与N能形成一种有毒离子CN-,能结合Fe3+形成配合物,写出一个与该离子互为等电子体的极性分子的分子式_____,HCN分子的空间构型为____________。
(5)单晶硅的结构与金刚石的结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子间不成键,则得如图所示的金刚砂(SiC)结构。
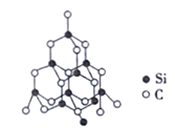
在SiC晶体中,C原子的杂化方式为_________,每个Si原子被_______个最小环所共有。
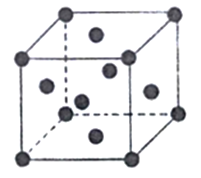
(6)已知Cu的晶胞结构如图,棱长为acm,又知Cu的密度为pg/cm3,则用a、p的代数式表示阿伏伽德罗常数为____mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铁和铜的混合物中,加入一定量的稀硝酸,使之充分反应,剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2 g,则m1与m2关系是( )
A.m1一定大于m2
B.m1可能小于m2
C.m1可能等于m2
D.m1一定等于m2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com