
【题目】25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是___;(填编号)
A.CO32- B.ClO- C.CH3COO- D.HCO3-
(2)下列反应不能发生的是___;
A.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
B.ClO-+CH3COOH=CH3COO- +HClO
C.CO32-+HClO=CO2↑+H2O+ClO-
D.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是___;
A.c(CH3COOH)/c(H+)
B.c(CH3COO-)/c(CH3COOH)
C.c(H+)/Kw
D.c(H+)/c(OH-)
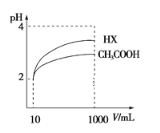
(4)体积为10 mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程pH变化如图所示,则HX的电离平衡常数__(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)___醋酸溶液中水电离出来的c(H+)。(填“大于”、“等于”或“小于”)
【答案】ABDC CD B 大于 大于
【解析】
从电离平衡常数得出酸性强弱为CH3COOH > H2CO3 > HClO > HCO3-;
⑴对应酸越弱结合氢离子能力越强,所以结合氢离子能力A > B > D > C,故答案为ABDC;
⑵根据相对强的酸制相对弱的酸原理
A选项,CO32-+CH3COOH=CH3COO-+CO2↑+H2O,醋酸大于碳酸,故A正确;
B选项,ClO-+CH3COOH=CH3COO-+HClO,醋酸大于次氯酸,故B正确;
C选项,CO32-+HClO=CO2↑+H2O+ClO-,由于碳酸大于次氯酸,不发生,故C错误;
D选项,2ClO-+CO2+H2O=CO32-+2HClO,次氯酸大于碳酸氢根,不发生,故D错误;
综上所述,答案为CD;
⑶用蒸馏水稀释0.10mol·L-1的醋酸,
A选项,![]() ,加水稀释,平衡正向移动,n(H+)增大,n(CH3COOH)减小,比值减小,故不选;
,加水稀释,平衡正向移动,n(H+)增大,n(CH3COOH)减小,比值减小,故不选;
B选项,![]() ,加水稀释平衡正向移动,n(CH3COOH)减小,n(CH3COO-)增大,所以比值增大,故选;
,加水稀释平衡正向移动,n(CH3COOH)减小,n(CH3COO-)增大,所以比值增大,故选;
C选项,加水稀释,c(H+)减小,Kw不变,所以c(H+)/Kw减小,故不选;
D选项,加水稀释,c(H+)减小,c(OH-)增大,所以c(H+)/c(OH-)减小,故不选;
综上所述,答案为B;
⑷体积为10 mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,加水稀释变化大的酸性相对较强,因此根据稀释过程pH变化如图,得出HX酸比醋酸强,则HX的电离平衡常数大于醋酸的平衡常数,稀释后,HX酸性比醋酸酸性弱,对水电离抑制程度比醋酸抑制水的能力弱,因此HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+),故答案为大于;大于。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某有机化合物的结构简式如图所示。有关该化合物的叙述不正确的是( )
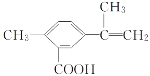
A.该有机物的分子式为C11H12O2
B.1mol该物质最多能与4molH2发生加成反应
C.该有机物在一定条件下,可以发生取代、氧化、酯化反应
D.该有机物与钠反应不如水与钠反应剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲利用浓盐酸、MnO2、Fe等试剂制取无水氯化铁、收集一定量的氯气并验证其某些性质,实验装置如图所示(制气装置省略)。下列说法错误的是

A.④中a导管应向下延伸至接近瓶底
B.若撤去⑥,则⑤中可能有Fe2O3生成
C.当⑤中充满黄绿色气体时再点燃⑤处酒精灯
D.③中试纸若是湿润的,则根据产生的现象可证明氯气有酸性,漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )
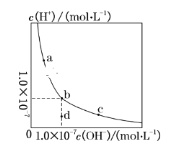
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-14
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比推理是化学中常用的思维方法。下列推理正确的是
A.![]() 晶体硅含
晶体硅含![]() 键的数目为
键的数目为![]() ,则
,则![]() 金刚砂含
金刚砂含![]() 键的数目也为
键的数目也为![]()
B.![]() 溶液中加入过量的
溶液中加入过量的![]() 溶液,发生化学反应的方程式:
溶液,发生化学反应的方程式:![]() ,则
,则![]() 溶液中加入过量的
溶液中加入过量的![]() 溶液,发生化学反应的方程式:
溶液,发生化学反应的方程式:![]()
C.标准状况下,![]() 中所含的分子数目为
中所含的分子数目为![]() 个,则
个,则![]() 中所含的分子数目也为
中所含的分子数目也为![]() 个
个
D.![]() 溶液中通入过量
溶液中通入过量![]() 发生了反应:
发生了反应:![]() ,则
,则![]() 溶液中通入过量
溶液中通入过量![]() 发生了:
发生了:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸。
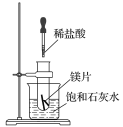
回答下列问题:
(1)实验中观察到的现象是________________。
(2)产生上述现象的原因是________________。
(3)写出有关反应的离子方程式____________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa的条件下,断裂1molH—H键吸收436kJ能量,断裂1molCl—Cl键吸收243kJ能量,形成1molH-Cl键放出431 kJ能量。H2+Cl2=2HCl的化学反应可用如图表示:
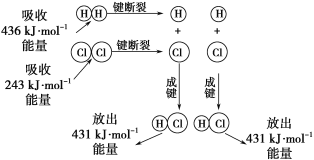
请回答下列有关问题:
(1)反应物断键吸收的总能量为___________________。
(2)生成物成键放出的总能量为______________。
(3)判断H2+Cl2=2HCl反应_____________(填“吸收”或“放出”)能量。
(4)反应物的总能量________(填“>”、“=”或“<”)生成物的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)![]() Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图22所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图22所示。下列判断正确的是( )

A. 往平衡体系中加入金属铅后,c(Pb2+)增大
B. 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C. 升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D. 25 ℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1= -26.7kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2= -50.75kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3= -36.5 kJ·mol-1
则反应FeO(s)+CO(g)=Fe(s)+CO2(g)的焓变为
A.+7.28kJ·mol-1B.7.28kJ·mol-1
C.+43.68kJ·mol-1D.43.68kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com