
【题目】类比推理是化学中常用的思维方法。下列推理正确的是
A.![]() 晶体硅含
晶体硅含![]() 键的数目为
键的数目为![]() ,则
,则![]() 金刚砂含
金刚砂含![]() 键的数目也为
键的数目也为![]()
B.![]() 溶液中加入过量的
溶液中加入过量的![]() 溶液,发生化学反应的方程式:
溶液,发生化学反应的方程式:![]() ,则
,则![]() 溶液中加入过量的
溶液中加入过量的![]() 溶液,发生化学反应的方程式:
溶液,发生化学反应的方程式:![]()
C.标准状况下,![]() 中所含的分子数目为
中所含的分子数目为![]() 个,则
个,则![]() 中所含的分子数目也为
中所含的分子数目也为![]() 个
个
D.![]() 溶液中通入过量
溶液中通入过量![]() 发生了反应:
发生了反应:![]() ,则
,则![]() 溶液中通入过量
溶液中通入过量![]() 发生了:
发生了:![]()
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】对于苯乙烯(![]() )有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
)有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
A. ①②③④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. 全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 表示阿伏加德罗常数的值。下列说法错误的是
表示阿伏加德罗常数的值。下列说法错误的是
A.![]() 与
与![]() 组成的混合物中,含有的电子数目为
组成的混合物中,含有的电子数目为![]()
B.![]() (标准状况)
(标准状况)![]() 与足量乙烷反应时,断裂的
与足量乙烷反应时,断裂的![]() 键数目为
键数目为![]()
C.![]() 浓度均为
浓度均为![]() 的
的![]() 、
、![]() 溶液中,
溶液中,![]() 数目前者比后者多
数目前者比后者多![]()
D.![]() [电离方程式:
[电离方程式:![]() ]消耗
]消耗![]() 数目最多为
数目最多为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在20.00 mL 0.1000 mol·L-1 NH3·H2O溶液中逐滴滴加0.1000 mol·L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图所示。下列说法正确的是

A. ①溶液:c(Cl-)>c(NH)>c(OH-)>c(H+)
B. ②溶液:c(NH)=c(Cl-)>c(OH-)=c(H+)
C. ①、②、③三点所示的溶液中水的电离程度②>③>①
D. 滴定过程中不可能出现:c(NH3·H2O)>c(NH)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物![]() 的重要用途之一是生产汽车刹车片,其合成路线如图所示:
的重要用途之一是生产汽车刹车片,其合成路线如图所示:

已知:![]() +
+![]()
![]()
![]()
(1)A→B的反应类型属于_____________,D的名称是_____________,烃F的分子式为____________。
(2)E中含有官能团的名称是___________,C的结构简式为____________。
(3)用文字叙述淀粉转化为A的原理:___________。
(4)写出G→H的化学方程式:__________。
(5)烃F有多种同分异构体,写出其同分异构体中含有2个相同官能团且无支链的链状物质的结构简式:_____(任写三种),其中核磁共振氢谱峰最少的一种物质有______个峰。
(6)写出以2—甲基—1,3—丁二烯和丙烯为原料合成![]() 的合成路线:______(无机试剂任选)。
的合成路线:______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是___;(填编号)
A.CO32- B.ClO- C.CH3COO- D.HCO3-
(2)下列反应不能发生的是___;
A.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
B.ClO-+CH3COOH=CH3COO- +HClO
C.CO32-+HClO=CO2↑+H2O+ClO-
D.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是___;
A.c(CH3COOH)/c(H+)
B.c(CH3COO-)/c(CH3COOH)
C.c(H+)/Kw
D.c(H+)/c(OH-)
(4)体积为10 mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程pH变化如图所示,则HX的电离平衡常数__(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)___醋酸溶液中水电离出来的c(H+)。(填“大于”、“等于”或“小于”)
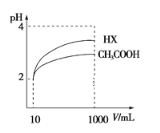
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化剂是化工技术的核心,绝大多数的化工生产需采用催化工艺。
Ⅰ.(1)催化剂的选择性指在能发生多种反应的反应系统中,同一催化剂促进不同反应的程度的比较,实质上是反应系统中目的反应与副反应之间反应速度竞争的表现。如图所示为一定条件下![]() 与
与![]() 发生反应时,生成
发生反应时,生成![]() 、
、![]() 或
或![]() 的能量变化图[反应物
的能量变化图[反应物![]() 和生成物
和生成物![]() 略去]。在有催化剂作用下,
略去]。在有催化剂作用下,![]() 与
与![]() 反应主要生成____(选填“
反应主要生成____(选填“![]() 或
或![]() 或
或![]() ”)。
”)。
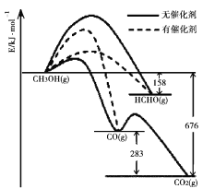
(2)2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家哈德·埃特尔,他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。埃特尔研究的氮气和氢气分子在固体催化剂表面发生的部分变化过程如图所示:
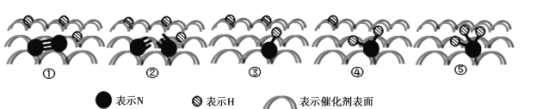
①下列说法不正确的是_________。
A.升高温度可以提高一段时间内![]() 的生产效率
的生产效率
B.图示中的②→③以及后面几个过程均是放热过程
C.此图示中存在![]() 键断裂和
键断裂和![]() 键断裂,以及
键断裂,以及![]() 键的形成过程
键的形成过程
②合成氨工业中,原料气(![]() 、
、![]() 及少量
及少量![]() 、
、![]() 的混合气)在进入合成塔前常用
的混合气)在进入合成塔前常用![]() (醋酸二氨合亚铜,
(醋酸二氨合亚铜,![]() 代表醋酸根)溶液来吸收原料气中的
代表醋酸根)溶液来吸收原料气中的![]() ,其反应是:
,其反应是:![]() ,生产中必须除去原料气中
,生产中必须除去原料气中![]() 的原因是_________;
的原因是_________;![]() 溶液吸收原料气中的
溶液吸收原料气中的![]() 的生产适宜条件应是____________。
的生产适宜条件应是____________。
Ⅱ.氮循环是指氮在自然界中的循环转化过程,是生物圈内基本的物质循环之一,存在较多蓝、绿藻类的酸性水体中存在如有图所示的氮循环,请回答相关问题。
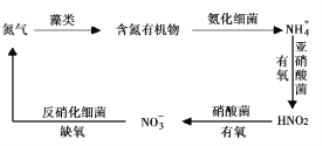
(3)![]() 硝化过程的方程式是
硝化过程的方程式是![]() ,恒温时在亚硝酸菌的作用下发生该反应,能说明体系达到平衡状态的是____(填标号)。
,恒温时在亚硝酸菌的作用下发生该反应,能说明体系达到平衡状态的是____(填标号)。
A.溶液的![]() 不再改变
不再改变
B.![]() 的消耗速率和
的消耗速率和![]() 的生成速率相等
的生成速率相等
C.溶液中![]() 、
、![]() 、
、![]() 的总物质的量保持不变
的总物质的量保持不变
实验测得在其它条件一定时,![]() 硝化反应的速率随温度变化曲线如下图A所示,温度高于35℃时反应速率迅速下降的原因可能是__________________。
硝化反应的速率随温度变化曲线如下图A所示,温度高于35℃时反应速率迅速下降的原因可能是__________________。

(4)亚硝酸盐含量过高对人和动植物都会造成直接或间接的危害,因此要对亚硝酸盐含量过高的废水进行处理。处理亚硝酸盐的方法之一是用次氯酸钠将亚硝酸盐氧化为硝酸盐,反应方程式是![]() 。在25℃和35℃下,分别向
。在25℃和35℃下,分别向![]() 初始浓度为
初始浓度为![]() 的溶液中按不同的投料比
的溶液中按不同的投料比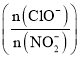 加入次氯酸钠固体(忽略溶液体积的变化),平衡时
加入次氯酸钠固体(忽略溶液体积的变化),平衡时![]() 的去除率和温度、投料比的关系如上图B所示,a、b、c、d四点
的去除率和温度、投料比的关系如上图B所示,a、b、c、d四点![]() 的转化率由小到大的顺序是______,35℃时该反应的平衡常数
的转化率由小到大的顺序是______,35℃时该反应的平衡常数![]() ______(保留三位有效数字)。
______(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α1和α2,c1和c2分别为两个恒容容器中平衡体系N2O4(g)![]() 2NO2(g)和3O2(g)
2NO2(g)和3O2(g)![]() 2O3(g)的反应物转化率及反应物的平衡浓度,在温度不变的情况下,均增加反应物的物质的量,下列判断正确的是
2O3(g)的反应物转化率及反应物的平衡浓度,在温度不变的情况下,均增加反应物的物质的量,下列判断正确的是
A. α1、α2均减小,c1、c2均增大
B. α1、α2均增大,c1、c2均减小
C. α1减小,α2增大,c1、c2均增大
D. α1减小,α2增大,c1增大,c2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在36g碳不完全燃烧所得气体中,CO占![]() 体积,CO2占
体积,CO2占![]() 体积,且C(s)+
体积,且C(s)+![]() O2(g)=CO(g) ΔH=-110.5 kJ/mol;CO(g)+
O2(g)=CO(g) ΔH=-110.5 kJ/mol;CO(g)+![]() O2(g)=CO2(g) ΔH=-283kJ/mol,与这些碳完全燃烧相比,损失的热量是
O2(g)=CO2(g) ΔH=-283kJ/mol,与这些碳完全燃烧相比,损失的热量是
A.172.5kJB.1149kJ
C.283kJD.566kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com