
【题目】A、B、C、D、E为元素周期表中前三周期元素形成的五种离子,A、B、C、D四种离子的电子数均比E(双核18电子离子)的电子数少8。
①A与B结合成的化合物甲中既有离子键又有共价键,A与C结合成的化合物乙难溶于水,乙溶于甲的水溶液得无色透明溶液,乙与甲的水溶液反应的离子方程式为__________;
②B与E结合成化合物丙,其中离子数之比为2∶1,A与D结合成化合物丁,丁与丙反应产生无色无味的气体,该反应的化学方程式为_____________;
③H2、O2和甲的水溶液可形成氢氧燃料电池,负极的电极反应为:___________;
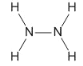
④有一种液态氮氢化合物戊,分子中氮与氢两种元素的质量比为7∶1,与E的电子数相同,是火箭发射时使用的高能燃料之一,结构分析发现该分子结构中只有单键,与氨相似,则戊的结构式为_______,1mol戊与过量盐酸反应的离子方程式是___________。
【答案】![]()
![]()
![]()
![]()
【解析】
A、B、C、D、E为元素周期表中前三周期元素形成的五种离子,A、B、C、D四种离子的电子数均比E(双核18电子离子)的电子数少8,E为双核18电子离子,则A、B、C、D为10电子的离子。常见的短周期元素形成的10电子离子是Ne原子的前后非金属形成的阴离子以及第三周期的金属形成的阳离子,
①A与B结合成的化合物甲中既有离子键又有共价键,且甲可溶于水,符合的物质为NaOH;A与C结合成乙难溶于水,则A为氢氧根离子,B为钠离子,C可能是镁离子或者铝离子,又因难溶物乙溶于甲的水溶液得无色透明溶液,则乙只能是氢氧化铝,C为铝离子,乙与甲的水溶液反应离子方程式:![]() ,故答案为:
,故答案为:![]() ;
;
②B与E结合成化合物丙,其中离子数之比为2∶1,B为钠离子,E为过氧根离子,A与D结合成化合物丁,丁与丙反应产生无色无味的气体,则丁为H2O,D为![]() ,丁与丙反应为
,丁与丙反应为![]() ,故答案为:
,故答案为:![]() ;
;
③H2、O2和氢氧化钠的水溶液可形成氢氧燃料电池,负极的电极反应为![]() ,故答案为:
,故答案为:![]() ;
;
④有一种液态氮氢化合物戊,分子中氮与氢两种元素的质量比为7∶1,则氮氢的个数比=![]() ,与E的电子数相同,即含18电子,则戊为N2H4,结构式为
,与E的电子数相同,即含18电子,则戊为N2H4,结构式为 ,1mol戊与过量盐酸反应类似于氨气与酸的反应,反应方程式为
,1mol戊与过量盐酸反应类似于氨气与酸的反应,反应方程式为![]() ,故答案为:
,故答案为: ;
;![]() 。
。
一核:Ne、N3-、O2-、F-、Na+、Mg2+、Al3+ | 二核:HF、OH- | ||
三核:H2O、NH2- | 四核:NH3、H3O+ | ||
五核:CH4 | |||
一核:Ar、K+、Ca2+、Cl-、S2- | 二核:F2、HCl、HS- | ||
三核:H2S | 四核:PH3、H2O2 | ||
五核:SiH4 CH3F | 六核:N2H4 CH3OH | ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)化合物A可由环戊烷经三步反应合成:
 (A)
(A)
已知:![]()
![]()
反应1的试剂与条件为_____;反应2的化学方程式为_____。
(2)如图是以环戊烷为原料制备环戊二烯的合成路线:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
其中,反应②的反应试剂和条件是_____,反应③的反应类型是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列热化学方程式分析,C(s)的燃烧热△H等于( )
C(s) + H2O(l) = CO(g) + H2(g) △H1=175.3kJ·mol-1
2CO(g) + O2(g) = 2CO2(g)△H2= —566.0 kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) △H3= —571.6 kJ·mol-1
A.△H1+△H2—△H3B.2△H1+△H2+△H3
C.△H1+△H2/2 +△H3D.△H1+△H2/2 +△H3/2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与科技、生产、生活密切相关。下列有关说法不正确的是
A.利用高纯单质硅的半导体性能,可以制成光电池,将光能直接转化为电能
B.天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源
C.我国首艘国产001A型航母用于舰载机降落的拦阻索是特种钢缆,属于金属材料
D.纳米铁粉可以高效去除污染水体中的![]() 、
、![]() 、
、![]() 、
、![]() 等重金属离子,其本质是纳米铁粉对重金属离子有较强的物理吸附
等重金属离子,其本质是纳米铁粉对重金属离子有较强的物理吸附
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.
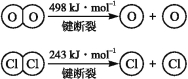
(1)反应A的热化学方程式是 。
(2)断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)实验①和②的目的是__________。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是_________(填一种方法即可)。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。
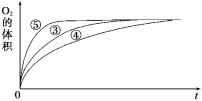
分析该图能够得出的实验结论是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与我们的生活息息相关,下列有关说法正确的是
A.聚乙烯是无毒高分子化合物,属于混合物
B.明矾可用于自来水的杀菌消毒
C.生活中用汽油去除衣物上的油污,用热的纯碱溶液洗涤炊具上的油污,两者的原理完全相同
D.![]() 、
、![]() 都是酸性氧化物,是形成酸雨的主要因素
都是酸性氧化物,是形成酸雨的主要因素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同的方式投入反应物,发生反应 N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol,测得反应的相关数据如下表:
2NH3(g) △H=-92.4kJ/mol,测得反应的相关数据如下表:
容器甲 | 容器乙 | 容器丙 | |
反应温度/℃ | 400 | 400 | 500 |
反应物投入量 | 1molN2,3molH2 | 4molNH3 | 1molN2,3molH2 |
平衡时v(正)(H2)/mol/(Ls) | v1 | v2 | v3 |
平衡时c(NH3)/(mol/L) | c1 | c2 | c3 |
平衡时总压强P/Pa | P1 | P2 | P3 |
物质的平衡转化率a | a1(N2) | a2(NH3) | a3(N2) |
平衡常数K | K1 | K2 | K3 |
下列关系正确的是
A. v1<v2,c1<2c2 B. c2>2c3,a2(NH3)+a3(N2)<1
C. K1>K3, P2>2P3 D. v1<v3,a1(N2)<a3(N2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L密闭容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
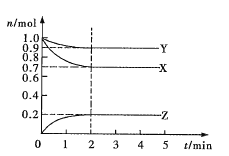
(1)该反应的化学方程式为______________。
(2)反应开始至2min,用Z表示的平均反应速率为_________。
(3)下列叙述能说明上述反应达到化学平衡状态的是________(填序号)
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗![]() X,同时生成
X,同时生成![]() Z
Z
D.混合气体的总质量不随时间的变化而变化
E.混合气体的密度不再发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com