
【题目】某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)实验①和②的目的是__________。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是_________(填一种方法即可)。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。
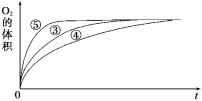
分析该图能够得出的实验结论是___________。
【答案】探究浓度对反应速率的影响 向反应物中加入等量同种催化剂(或升高相同的温度) 碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率
【解析】
(1)根据实验①、②的不同判断影响因素,要使反应发生,可在其中加入、等量催化剂,判断外界条件的影响;
(3)实验③④⑤中都使用了催化剂,双氧水的浓度相同,不同点是溶液酸碱性不同,根据溶液酸碱性与反应产生氧气最大量的时间长短判断反应速率及影响因素。
(1)实验①和②其它外界条件相同,只有H2O2的浓度不同,可见实验的目的是探究浓度对反应速率的影响;根据资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,对原实验方案的改进方法可以是向反应物中加入等量同种催化剂,或适当升高相应的温度;
(2)通过表格数据可知:实验③④⑤中都使用了相同量的同种催化剂,而且双氧水的浓度、体积也都相同,不同点是溶液酸碱性不同。根据图象可知:溶液酸碱性不同,反应快慢不同,产生最大量氧气所需时间不同。溶液呈碱性能增大H2O2分解的速率,溶液呈酸性环境能减小H2O2分解的速率。


科目:高中化学 来源: 题型:
【题目】硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
(1)基态硒原子的价层电子排布式为______________。
(2)锗、砷、硒的第一电离能大小排序为_______________。H2SeO4的酸性比H2SeO3的强,其原因是______________________。
(3)H2SeO3的中心原子杂化类型是_________;SeO32-的立体构型是___________。与SeO42-互为等电体的分子有(写一种物质的化学式即可)_______________。
(4)H2Se属于_________(填:极性或非极性)分子;单质硒的熔点为217℃,它属于________晶体。
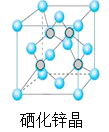
(5)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为____________;若该晶胞密度为ρgcm-3,硒化锌的摩尔质量为M g/mol。NA代表阿伏加德罗常数,则晶胞参数a为___________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)在第二周期中(稀有气体除外),第一电离能最大的元素的原子结构示意图是___,第一电离能最小的元素的电子排布图为___。
(2)以下是一些原子的2p能级和3d能级中电子排布的情况.试判断,哪些违反了泡利不相容原理,哪些违反了洪特规则。
①![]() ②
②![]() ③
③ ![]() ④
④![]() ⑤
⑤ ![]() ⑥
⑥ ![]()
违反泡利不相容原理的有__,违反洪特规则的有___。
(3)用VSEPR模型和杂化轨道理论相关知识填表:
分子或离子 | 中心原子轨道杂化形式 | 分子或离子的立体结构 | 分子有无极性 |
CH2O | ________ | _______ | _____ |
NH4+ | ________ | _______ | _____ |
CS2 | ________ | _______ | _____ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于自然资源开发利用的说法错误的是
A.根据金属活泼性不同,冶炼金属采用的方法不同
B.通过煤的气化和液化等化学变化可将煤变为清洁能源
C.以石油、煤和天然气为原料可生产塑料、合成橡胶和合成纤维
D.从海带中提取碘经历的步骤有:灼烧![]() 浸泡
浸泡![]() 过滤
过滤![]() 萃取
萃取![]() 粗碘提纯
粗碘提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为元素周期表中前三周期元素形成的五种离子,A、B、C、D四种离子的电子数均比E(双核18电子离子)的电子数少8。
①A与B结合成的化合物甲中既有离子键又有共价键,A与C结合成的化合物乙难溶于水,乙溶于甲的水溶液得无色透明溶液,乙与甲的水溶液反应的离子方程式为__________;
②B与E结合成化合物丙,其中离子数之比为2∶1,A与D结合成化合物丁,丁与丙反应产生无色无味的气体,该反应的化学方程式为_____________;
③H2、O2和甲的水溶液可形成氢氧燃料电池,负极的电极反应为:___________;
④有一种液态氮氢化合物戊,分子中氮与氢两种元素的质量比为7∶1,与E的电子数相同,是火箭发射时使用的高能燃料之一,结构分析发现该分子结构中只有单键,与氨相似,则戊的结构式为_______,1mol戊与过量盐酸反应的离子方程式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置进行中和热的测定。回答下列问题:
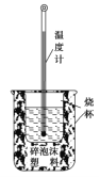
(1)该图中有两处未画出,它们是 ____________、_______________;
(2)在操作正确的前提下提高中和热测定的准确性的关键是____________________;
(3)如果用50 mL0.50 mol/L的盐酸和0.03 mol氢氧化钠固体进行实验,则实验中所测出的“中和热”的热值将____________(填“偏大”、“偏小”或“不变”);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】425℃时,在两个1L密闭容器中分别发生化学反应,物质的浓度随时间的变化如图所示。下列叙述错误的是( )

A.图①中t0时,三种物质的物质的量相等
B.图①中![]() 时,反应达到平衡状态
时,反应达到平衡状态
C.图②中的可逆反应为2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)
D.图①②中,当c(HI)=3.16mol/L时,两容器中的反应均达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)亚硝酰氯(ClNO)是有机合成中常用试剂,已知:2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0,一定温度下,将2 molNO与2 molCl2置于2L密闭容器中发生反应。
2ClNO(g) △H<0,一定温度下,将2 molNO与2 molCl2置于2L密闭容器中发生反应。
①下列可判断反应达平衡状态的是___________(填序号字母)。
A. 混合气体的平均相对分子质量不变 B. 混合气体密度保持不变
C. NO和Cl2的物质的量之比保持不变 D. 每消耗1 moI NO同时生成1molClNO
②为了加快化学反应速率,同时提高NO的转化率,其他条件不变时,可采取的措施有_________(填选项序号字母)。
A. 升高温度 B. 缩小容器体积 C. 再充入Cl2气体 D. 使用合适的催化剂
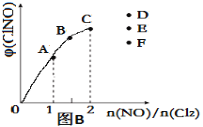
③一定条件下在恒温恒容的密闭容器中,按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图(B)所示,当n(NO)/n(Cl2)=2.5时,达到平衡状态,ClNO的体积分数可能是下图中D、E、F三点中的________点。
(2) 在体积为10 L的密闭容器中充入3 mol NO和2 mol Cl2,在不同温度下发生反应2NO(g)+Cl2(g)![]() 2ClNO(g),ClNO的百分含量随时间的变化如图所示。已知T1>T2>T3。
2ClNO(g),ClNO的百分含量随时间的变化如图所示。已知T1>T2>T3。
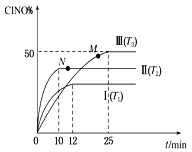
①与实验Ⅰ相比,实验Ⅱ除温度不同外,还改变的条件是__________________。
②实验Ⅲ反应至25 min达到平衡,用NO物质的浓度变化表示的反应速率为__________________。达到平衡时,若实验Ⅲ达到平衡时的热量变化为Q kJ,则该反应的热化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向25 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,滴定曲线如图所示,下列说法正确的是
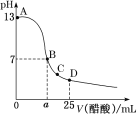
A. 在A、B间任一点的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. 用含a的代数式表示CH3COOH的电离常数K=2.5×10—7/(0.2a-2.5)
C. C点对应的溶液中,水电离出的H+浓度大于10-7 mol·L-1
D. D点对应的溶液中,存在如下关系:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com