
【题目】I、“蓝天白云”是现代城市人向往的目标,而机动车尾气已成为城市大气的主要污染源,机动车尾气中的主要有害物质为氮的氧化物目前科技工作者正在探索用甲烷等燃料气体将氮氧化物还原为N2和水,涉及到的反应有:
CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+2NO2(g) =CO2(g)+2H2O(g)+N2(g) ΔH2=-867 kJ·mol-1
写出CH4还原NO生成N2的热化学方程式: ____________
Ⅱ、一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X发生反应:
pX(g)Y(g)+Z(g)相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
A | 387 | 0.20 | 0.080 | 0.080 |
B | 387 | 0.40 | 0.160 | 0.160 |
C | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器A中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器A和容器B中起始时X的反应速率v(X)A___________v(X)B(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”)。
(3)容器B中X的平衡转化率为___________,若起始时向容器A中充入0.1molX、0.15molY和0.10molZ,则反应将向___________(填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________
Ⅲ、科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4下列关于该太电池的叙述错误的是____________
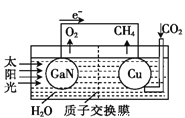
A.电池工作时,是将太阳能转化为电能
B.铜电极为正极,电极反应式为:CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
D.为提高该人工光合系统的工作效率,可向装置中加入少量硝酸溶液
【答案】CH4 (g)+4NO(g)![]() 2N 2 (g)+CO2 (g)+2H2O(g) ΔH=1160 kJ·mol1 0.004molL-1min-1 小于 小于 80% 正 浓度商小于平衡常数,要使得生成物增加,则平衡将向正反应方向进行 AD
2N 2 (g)+CO2 (g)+2H2O(g) ΔH=1160 kJ·mol1 0.004molL-1min-1 小于 小于 80% 正 浓度商小于平衡常数,要使得生成物增加,则平衡将向正反应方向进行 AD
【解析】
I根据盖斯定律,第2个方程乘以2再减去第2个方程,得到CH4还原NO生成N2的热化学方程式:CH4 (g)+4NO(g)![]() 2N2 (g)+CO2 (g)+2H2O(g) ΔH=1160 kJ·mol1。
2N2 (g)+CO2 (g)+2H2O(g) ΔH=1160 kJ·mol1。
⑴若容器Ⅰ中反应经10min达到平衡,则前10min内Y的平均反应速率![]() ,起始时A中X的浓度小于B中X的浓度,因此容器A和容器B中起始时X的反应速率v(X)A小于v(X)B。
,起始时A中X的浓度小于B中X的浓度,因此容器A和容器B中起始时X的反应速率v(X)A小于v(X)B。
⑵该正反应为放热反应,A容器与C容器分析,Y的量增加,说明平衡正向移动,正向是放热反应,说明是降温,因此T小于387。
⑶根据A、B容器装入X的量和平衡时的Y、Z的量,得出该反应是等体积反应,容器B中Y为0.16mol,说明X消耗了0.32mol,则X剩余0.08mol,则X的平衡转化率为![]() ,A容器平衡时Y的量为0.08mol,则X消耗0.16mol,剩余0.04mol,平衡时平衡常数
,A容器平衡时Y的量为0.08mol,则X消耗0.16mol,剩余0.04mol,平衡时平衡常数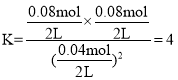 ,若起始时向容器A中充入0.1molX、0.15molY和0.10molZ,
,若起始时向容器A中充入0.1molX、0.15molY和0.10molZ,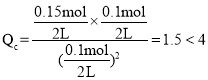 ,浓度商小于平衡常数,要使得生成物增加,则平衡正向移动,因此反应将向正反应方向进行。
,浓度商小于平衡常数,要使得生成物增加,则平衡正向移动,因此反应将向正反应方向进行。
Ⅲ、A选项,电池工作时,是将太阳能转化为电能和化学能,故A错误;B选项,铜电极是二氧化碳化合价降低,为正极,其电极反应式为:CO2+8e-+8H+=CH4+2H2O,故B正确;C选项,电池内部“同性相吸”,则H+透过质子交换膜从左向右移动,故C正确;D选项,硝酸和铜要反应,损失正极,故D错误。
I根据盖斯定律,第2个方程乘以2再减去第2个方程,得到CH4还原NO生成N2的热化学方程式:CH4 (g)+4NO(g)![]() 2N2 (g)+CO2 (g)+2H2O(g) ΔH=1160 kJ·mol1,故答案为:CH4 (g)+4NO(g)
2N2 (g)+CO2 (g)+2H2O(g) ΔH=1160 kJ·mol1,故答案为:CH4 (g)+4NO(g)![]() 2N2 (g)+CO2 (g)+2H2O(g) ΔH=1160 kJ·mol1。
2N2 (g)+CO2 (g)+2H2O(g) ΔH=1160 kJ·mol1。
⑴若容器Ⅰ中反应经10min达到平衡,则前10min内Y的平均反应速率![]() ,起始时A中X的浓度小于B中X的浓度,因此容器A和容器B中起始时X的反应速率v(X)A小于v(X)B,故答案为:0.004molL-1min-1;小于。
,起始时A中X的浓度小于B中X的浓度,因此容器A和容器B中起始时X的反应速率v(X)A小于v(X)B,故答案为:0.004molL-1min-1;小于。
⑵该正反应为放热反应,A容器与C容器分析,Y的量增加,说明平衡正向移动,正向是放热反应,说明是降温,因此T小于387,故答案为:小于。
⑶根据A、B容器装入X的量和平衡时的Y、Z的量,得出该反应是等体积反应,容器B中Y为0.16mol,说明X消耗了0.32mol,则X剩余0.08mol,则X的平衡转化率为![]() ,A容器平衡时Y的量为0.08mol,则X消耗0.16mol,剩余0.04mol,平衡时平衡常数
,A容器平衡时Y的量为0.08mol,则X消耗0.16mol,剩余0.04mol,平衡时平衡常数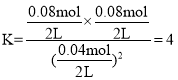 ,若起始时向容器A中充入0.1molX、0.15molY和0.10molZ,
,若起始时向容器A中充入0.1molX、0.15molY和0.10molZ,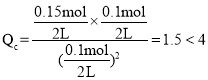 ,浓度商小于平衡常数,要使得生成物增加,则平衡正向移动,因此反应将向正反应方向进行,故答案为:正;浓度商小于平衡常数,要使得生成物增加,则平衡将向正反应方向进行。
,浓度商小于平衡常数,要使得生成物增加,则平衡正向移动,因此反应将向正反应方向进行,故答案为:正;浓度商小于平衡常数,要使得生成物增加,则平衡将向正反应方向进行。
Ⅲ、A选项,电池工作时,是将太阳能转化为电能和化学能,故A错误;B选项,铜电极是二氧化碳化合价降低,为正极,其电极反应式为:CO2+8e-+8H+=CH4+2H2O,故B正确;C选项,电池内部“同性相吸”,则H+透过质子交换膜从左向右移动,故C正确;D选项,硝酸和铜要反应,损失正极,故D错误;综上所述,答案为AD。


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】如图是全钒液流储能电池的示意图,a、b是碳电极,几种含钒元素的离子在水溶液中颜色如表所列,全钒液中还含有H+、SO42-,下列说法中错误的是

V2+ | V3+ | VO2+ | VO2+ |
紫色 | 绿色 | 蓝色 | 黄色 |
A.当外接负载时,右槽溶液若逐渐由紫变绿,则b为负极
B.当外接负载时,电流若由a流出,则左槽溶液的pH增大
C.当b与外接电源负极相连时,则b极发生V3++e—=V2+
D.充电时若电路中转移0.1 mol电子,则左槽溶液中n(H+)的变化量为0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】克伦特罗是一种平喘药,但被违法添加在饲料中,俗称“瘦肉精”,其结构简式如图。下列有关“瘦肉精”的说法正确的是

A. 它的分子式为C12H17N2Cl2O
B. 它含有氨基、氯原子、碳碳双键等官能团
C. 1mol克伦特罗最多能和3 molH2发生加成反应
D. 一定条件下它能发生水解反应、酯化反应、消去反应、氧化反应、加聚反应等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺。工艺流程如图:
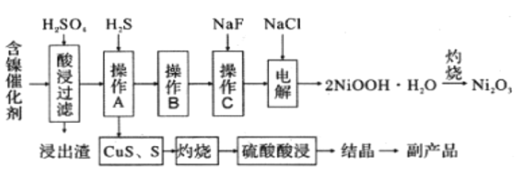
已知:①常温下,有关氢氧化物开始沉淀和沉淀完全的pH如表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.7 | 9.7 | 9.2 |
②常温下,Ksp(CaF2)= 2.7×10-11
回答下列问题:
(1)加快酸浸速率的常用措施有_____________(任写一条)。
(2)写出酸浸时Fe2O3和硫酸反应的离子方程式________________________________。
(3)浸出渣主要成分为CaSO4·2H2O和______________两种物质。
(4)操作B的过程是先在40~50℃加入H2O2,其作用是___________________________(用离子方程式表示);再调节PH至3.7~7.7,操作B可除去溶液中的______元素(填元素名称)。
(5)操作C可除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol/L,则溶液中c(Ca2+):c(F-) =___________________。
(6)在碱性条件下,电解产生2NiOOH·H2O的原理分两步:
① Cl- 在阳极被氧化为ClO-,则阳极的电极反应为_____________________。
② Ni2+ 被ClO-氧化产生2NiOOH·H2O沉淀,则该步反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“中和滴定原理在实际生产生活中应用广泛某化学学习小组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资和网络查寻,得知草酸易溶于水,其水溶液可以用酸性KMnO4溶液进行滴定,反应原理为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
回答下列问题:
(1)该滴定实验所需的玻璃仪器有______。
A.酸式滴定管(50mL) B.碱式滴定管(50mL) C.量筒(50mL) D.锥形瓶 E.烧杯
(2)滴定终点的现象为_____________________________________________________。
(3)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测H2C2O4溶液的体积/mL | 0.100mol·L-1KMnO4的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 滴液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该H2C2O4溶液的物质的量浓度______________。(计算结果保留四位有效数字)
(4)讨论:若滴定到终点时俯视滴定管刻度线读数,则由此测得的x值会______________(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗曾做过这样一个实验:“一个抽空的密闭容器重Mg,在标准状况下,盛满相同物质的量的NO和H2的混合气体后,称量为(M+Q)g。把混合气体排尽,再充满SO2气体,为使天平平衡,应在托盘天平的 边托盘上放置 g砝码。”横线上分别应填的是 ( )
A.右 (M+2Q)
B.右 (M+4Q)
C.左 (M+2Q)
D.左 (M+4Q)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对电解质溶液作如下归纳总结(均在常温下),正确的是( )
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度均降低
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2:1
③pH相等的四种溶液:a.CH3COONa;b.NaClO;c.NaHCO3;d.NaOH。其溶液物质的量浓度由小到大顺序为d、b、c、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)= 2c(SO42-)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7
A.①②④B.③④⑥C.④⑤⑥D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在20.00 mL 0.1000 mol·L-1 NH3·H2O溶液中逐滴滴加0.1000 mol·L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图所示。下列说法正确的是
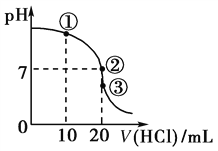
A. ①溶液:c(Cl-)>c(NH)>c(OH-)>c(H+)
B. ②溶液:c(NH)=c(Cl-)>c(OH-)=c(H+)
C. ①、②、③三点所示的溶液中水的电离程度②>③>①
D. 滴定过程中不可能出现:c(NH3·H2O)>c(NH)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A.化学平衡常数的表达式K=![]()
B.当v正(NH3)∶v正(NO)=1∶1时,说明该化学反应已经达到平衡状态
C.若达到平衡状态时两种反应物的转化率相等,则起始投入时n(NH3)∶n(O2)=4∶5
D.反应达到平衡状态后,改变条件使平衡向正反应方向移动,c(H2O)一定增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com