
【题目】克伦特罗是一种平喘药,但被违法添加在饲料中,俗称“瘦肉精”,其结构简式如图。下列有关“瘦肉精”的说法正确的是

A. 它的分子式为C12H17N2Cl2O
B. 它含有氨基、氯原子、碳碳双键等官能团
C. 1mol克伦特罗最多能和3 molH2发生加成反应
D. 一定条件下它能发生水解反应、酯化反应、消去反应、氧化反应、加聚反应等
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是
① FeS2![]() SO2
SO2![]() H2SO4
H2SO4
② SiO2![]() SiCl4
SiCl4![]() Si
Si
③ 饱和NaCl溶液![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
④ 1 mol·L-1HCl(aq)![]() Cl2
Cl2![]() Ca(ClO)2
Ca(ClO)2
⑤ CuSO4(aq) ![]() Cu(OH)2
Cu(OH)2 ![]() Cu2O
Cu2O
A. ①③⑤ B. ②③④ C. ②④⑤ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种环境激素,存在如下转化关系:
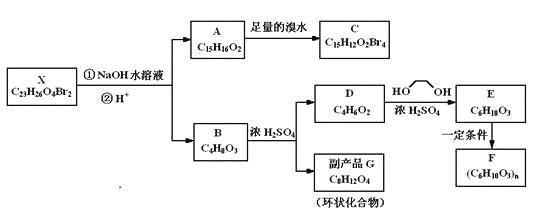
化合物A能与FeCl3溶液发生显色反应,分子中含有两个化学环境完全相同的甲基,其苯环上的一硝基取代物只有两种。1H-NMR谱显示化合物G的所有氢原子化学环境相同。F是一种可用于制备隐形眼镜的高聚物。
根据以上信息回答下列问题。
(1)下列叙述正确的是_________。
A.化合物A分子中含有联苯结构单元 |
B.化合物A可以和NaHCO3溶液反应,放出CO2气体 |
C.X与NaOH溶液反应,理论上1 mol X最多消耗6 mol NaOH |
D.化合物D能与Br2发生加成反应 |
(2)化合物C的结构简式是_________________,A→C的反应类型是________。
(3)写出同时满足下列条件的D的所有同分异构体的结构简式(不考虑立体异构_________。
a.属于酯类 b.能发生银镜反应
(4)写出B→C反应的化学方程式_______________________________________________。
(5)写出E→F反应的化学方程式_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)按系统命名法命名下列各物质。
(1)CH3-CH(CH3)-CH2-C(CH3)3 __________________________________。
(2) (CH3)2CH-CH=CH-CH2-CH3 __________________________________。
(二)某有机物A的结构简式如图。书写下列化学方程式
A 
(1)A跟NaOH溶液反应的化学方程式是:_____________。
(2)A跟Na2CO3溶液反应的化学方程式是:____________________。
(3)A在一定条件下跟Na反应的化学方程式是:__________。
(4)A在一定条件下跟过量的H2反应的化学方程式是:_________________。
(5)乙二醛发生银镜反应的化学方程式是:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O

对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________________________
(3)吸收液吸收SO2的过程中,pH随n(SO3﹣):n(HSO3﹣)变化关系如下表:
n(SO﹣):n(HSO﹣) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显______性,用化学平衡原理解释:____________
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____________
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
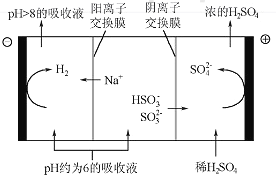
①HSO3-在阳极放电的电极反应式是_______________。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1mol·L-1的CH3COOH溶液滴定20mL0.1mol·L-1的NaOH溶液,当滴加VmLCH3COOH溶液时,混合溶液的pH=7。已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,下列关系式正确的是
A.Ka=![]() B.V=
B.V=![]() C.Ka=
C.Ka=![]() D.Ka=
D.Ka=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、“蓝天白云”是现代城市人向往的目标,而机动车尾气已成为城市大气的主要污染源,机动车尾气中的主要有害物质为氮的氧化物目前科技工作者正在探索用甲烷等燃料气体将氮氧化物还原为N2和水,涉及到的反应有:
CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+2NO2(g) =CO2(g)+2H2O(g)+N2(g) ΔH2=-867 kJ·mol-1
写出CH4还原NO生成N2的热化学方程式: ____________
Ⅱ、一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X发生反应:
pX(g)Y(g)+Z(g)相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
A | 387 | 0.20 | 0.080 | 0.080 |
B | 387 | 0.40 | 0.160 | 0.160 |
C | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器A中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器A和容器B中起始时X的反应速率v(X)A___________v(X)B(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”)。
(3)容器B中X的平衡转化率为___________,若起始时向容器A中充入0.1molX、0.15molY和0.10molZ,则反应将向___________(填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________
Ⅲ、科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4下列关于该太电池的叙述错误的是____________
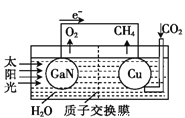
A.电池工作时,是将太阳能转化为电能
B.铜电极为正极,电极反应式为:CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
D.为提高该人工光合系统的工作效率,可向装置中加入少量硝酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 HX溶液,溶液的pH随加入NaOH溶液体积变化如图。下列说法不正确的是

A. HX为弱酸
B. V1 <20
C. M点溶液中离子浓度由大到小的顺序为:c(X-)>c(Na+)>c(H+)>c(OH-)
D. 二者等体积混合时,c(Na+)=c(X-) + c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com