
【题目】25℃时,用0.1mol·L-1的CH3COOH溶液滴定20mL0.1mol·L-1的NaOH溶液,当滴加VmLCH3COOH溶液时,混合溶液的pH=7。已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,下列关系式正确的是
A.Ka=![]() B.V=
B.V=![]() C.Ka=
C.Ka=![]() D.Ka=
D.Ka=![]()
科目:高中化学 来源: 题型:
【题目】在一定温度下,改变反应物中n(SO2),对反应2SO2(g)+O2(g)2SO3(g) ΔH<0的影响如图所示,下列说法正确的是( )
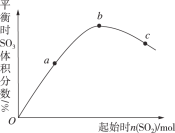
A.反应bc点均为平衡点,a点未达到平衡且向正反应方向进行
B.abc三点的平衡常数Kb>Kc>Ka
C.上述图象可以得出SO2的含量越高得到的混合气体中SO3的体积分数越高
D.abc三点中,a点时SO2的转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。

填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):________________________。
(2)试管C中苯的作用是 。反应开始后,观察D和E两试管,看到的现象分别为 、 。
(3)反应2~3 min后,在B中的NaOH溶液里可观察到的现象是 。
(4)在上述整套装置中具有防倒吸作用的仪器有 (填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】克伦特罗是一种平喘药,但被违法添加在饲料中,俗称“瘦肉精”,其结构简式如图。下列有关“瘦肉精”的说法正确的是

A. 它的分子式为C12H17N2Cl2O
B. 它含有氨基、氯原子、碳碳双键等官能团
C. 1mol克伦特罗最多能和3 molH2发生加成反应
D. 一定条件下它能发生水解反应、酯化反应、消去反应、氧化反应、加聚反应等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象及得出的结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向盛有品红的两只试管中分别通入SO2和Cl2 | 品红均褪色 | 两者漂白原理相同 |
B | 向体积相同且pH均为3.3的一元酸HX和HY中分别加入足量锌粒 | 产生的H2前者比后者多 | HX、HY均是弱酸 |
C | 在难溶性FeS和CuS中分别加入0.3mol/L盐酸 | 前者溶解,后者不溶 | Ksp(FeS)>Ksp(CuS) |
D | 向盛有相同体积、10%H2O2溶液的两只试管中分别加入足量酸性KMnO4溶液和FeCl3溶液 | 前者产生的气体多 | KMnO4催化活性比FeCl3高 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺。工艺流程如图:
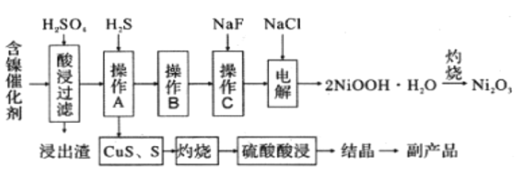
已知:①常温下,有关氢氧化物开始沉淀和沉淀完全的pH如表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.7 | 9.7 | 9.2 |
②常温下,Ksp(CaF2)= 2.7×10-11
回答下列问题:
(1)加快酸浸速率的常用措施有_____________(任写一条)。
(2)写出酸浸时Fe2O3和硫酸反应的离子方程式________________________________。
(3)浸出渣主要成分为CaSO4·2H2O和______________两种物质。
(4)操作B的过程是先在40~50℃加入H2O2,其作用是___________________________(用离子方程式表示);再调节PH至3.7~7.7,操作B可除去溶液中的______元素(填元素名称)。
(5)操作C可除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol/L,则溶液中c(Ca2+):c(F-) =___________________。
(6)在碱性条件下,电解产生2NiOOH·H2O的原理分两步:
① Cl- 在阳极被氧化为ClO-,则阳极的电极反应为_____________________。
② Ni2+ 被ClO-氧化产生2NiOOH·H2O沉淀,则该步反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“中和滴定原理在实际生产生活中应用广泛某化学学习小组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资和网络查寻,得知草酸易溶于水,其水溶液可以用酸性KMnO4溶液进行滴定,反应原理为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
回答下列问题:
(1)该滴定实验所需的玻璃仪器有______。
A.酸式滴定管(50mL) B.碱式滴定管(50mL) C.量筒(50mL) D.锥形瓶 E.烧杯
(2)滴定终点的现象为_____________________________________________________。
(3)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测H2C2O4溶液的体积/mL | 0.100mol·L-1KMnO4的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 滴液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该H2C2O4溶液的物质的量浓度______________。(计算结果保留四位有效数字)
(4)讨论:若滴定到终点时俯视滴定管刻度线读数,则由此测得的x值会______________(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对电解质溶液作如下归纳总结(均在常温下),正确的是( )
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度均降低
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2:1
③pH相等的四种溶液:a.CH3COONa;b.NaClO;c.NaHCO3;d.NaOH。其溶液物质的量浓度由小到大顺序为d、b、c、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)= 2c(SO42-)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7
A.①②④B.③④⑥C.④⑤⑥D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组运用如图所示组合装置(部分夹持装置未画出)进行探究实验。
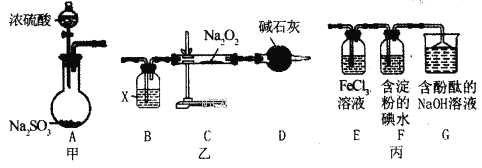
请回答下列问题:
(1)A同学将甲、乙装置组合进行实验,其实验目的是探究__反应的生成物;在连接好装置后,首先要进行的实验操作为___。
(2)为检验C装置中反应生成物是否有氧气,装置B中盛放的试剂X应为__,装置D中碱石灰的作用是__;
(3)B同学将甲、丙装置组合进行实验,能说明I-的还原性弱于SO2的现象为__,发生反应的离子方程式是__。
(4)装置G中的现象是__,说明SO2具有__性。
(5)为验证装置E中SO2与FeCl3发生了氧化还原反应,C同学设计了两套方案,完成下表:
实验操作 | 实验现象 | 实验结论 | |
方案1 | 取少量装置E中的溶液于试管中,向其中滴加___溶液 | 产生白色沉淀 | SO2与FeCl3发生了氧化还原反应 |
方案2 | 取少量装置E中的溶液于试管中,向其中滴加___溶液 | ___ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com