
【题目】常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1 mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )

A. 原合金质量为 0.92 g
B. 产生氧气的体积为896 mL(标准状况下)
C. 图中m的值为1.56
D. 图中V2的值为60
【答案】C
【解析】试题分析:反应后得到20 mL pH=14的溶液,所以n(OH-)=0.02mol,所以需要1mol/L的盐酸20mL来中和,因此V1为20mL,继续加盐酸发生AlO2-+H++H2O=Al(OH)3,Al(OH)3+3H+=Al3++3H2O,因此沉淀AlO2-用掉20mL盐酸,溶解Al(OH)3用掉60mL盐酸,所以V2为100mL。所以Al(OH)3为0.02mol,则m为1.56g,原混合物中含有Al为0.54g,当盐酸加100mL时,溶液中的溶质为NaCl和AlCl3,又知n(Cl-)=0.1mol,n(Al3+)=0.02mol,所以n(Na+)=0.04mol。所以原混合物中有Na为0.04mol,质量为0.92g,所以原混合物的质量为0.92g+0.54g=1.46g。反应过程中产生氢气0.05mol,1120mL,则C正确;答案选C。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1 mol FeI2与1 mol Cl2反应时转移的电子数为3NA
B. 2 g H![]() O与D
O与D![]() O的混合物中所含中子、电子数目均为NA
O的混合物中所含中子、电子数目均为NA
C. 273 K、101 kPa下,28 g乙烯与丙烯混合物中含有C—H键的数目为5NA
D. pH=1的H2SO4溶液10 L,含H+的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I .合成氨工业在现代农业、国防工业中,有着重要的地位
己知:N2 (g) +3H2 (g) ![]() 2NH3 (g) △H=-92 kJ·mol-1
2NH3 (g) △H=-92 kJ·mol-1
(1)下列有关该反应速率的叙述,正确的是(选填序号)____________。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,但可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量—定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)对于合成氨反应而言,如图有关图象一定正确的是(选填序号) ______________。

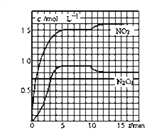
II.向2L的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:
①2NO(g) + O2(g) =2NO2 (g) ②2NO2 (g) ==N2O4 (g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃。
(1)计算前5min N2O4反应的平均速率为________________________。
(2)计算T1℃时反应②的化学平衡常数为_______________________。
(3)若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,判断T1℃时反应②进行的方向_____(正向、逆向、不移动),并计算达到平衡时N2O4的物质的量为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )
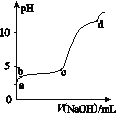
A. a点时,溶液呈酸性的原因是Al3+水解,离子方程式为Al3++3OH-![]() Al(OH)3
Al(OH)3
B. a~b段,溶液pH增大,Al3+浓度不变
C. b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D. d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2 L的恒容密闭容器中发生反应:CO2(g)+H2S(g)![]() COS(g)+H2O(g)。
COS(g)+H2O(g)。
容器 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
CO2 | H2S | H2O | |||
I | 607 | 0.1 | 0.15 | 0.05 | |
Ⅱ | 607 | 0.2 | 0.3 | ||
Ⅲ | 627 | 0.1 | 0.15 | 6×l0-3 | |
下列说法正确的是
A. 该反应为吸热反应
B. 容器Ⅲ达到平衡时,再充入少量氦气,平衡将向正反应方向移动
C. 容器Ⅱ达到平衡时,容器中COS的物质的量浓度为0.025 mol L-1
D. 607 K时,该反应的平衡常数为0.50
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为P-P:a kJ·mol-1、P—O:b kJ·mol-1、P===O:c kJ·mol-1、O===O:d kJ·mol-1。根据下图所示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )

A. (6a+5d-4c-12b) kJ·mol-1
B. (4c+12b-6a-5d) kJ·mol-1
C. (4c+12b-4a-5d) kJ·mol-1
D. (4a+5d-4c-12b) kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com