
����Ŀ��I .�ϳɰ���ҵ���ִ�ũҵ��������ҵ�У�������Ҫ�ĵ�λ
��֪��N2 (g) +3H2 (g) ![]() 2NH3 (g) ��H=-92 kJ��mol-1
2NH3 (g) ��H=-92 kJ��mol-1
(1)�����йظ÷�Ӧ���ʵ���������ȷ����(ѡ�����)____________��
a.�����¶ȿ����������Ӱٷ������ӿ췴Ӧ����
b.����ѹǿ�����������Ӱٷ����������Լӿ췴Ӧ����
c.ʹ�ô�������ʹ��Ӧ�����ƽ���������ߣ��ӿ췴Ӧ����
d.����������������£����������ı������С���Է�Ӧ����������Ӱ��
(2)���ںϳɰ���Ӧ���ԣ���ͼ�й�ͼ��һ����ȷ����(ѡ�����) ______________��

II.��2L���ܱ������г���7.6molNO��3.8mol O2���������·�Ӧ��
��2NO(g) + O2(g) =2NO2 (g) ��2NO2 (g) ==N2O4 (g)
���NO2��N2O4��Ũ�ȱ仯��ͼ��ʾ��0~10minά�������¶�ΪT1�棬10min�����߲�ά���������¶�ΪT2�档
(1)����ǰ5min N2O4��Ӧ��ƽ������Ϊ________________________��
(2)����T1��ʱ��Ӧ���Ļ�ѧƽ�ⳣ��Ϊ_______________________��
(3)����ʼʱ��������г���3.6mol NO2��2.0mol N2O4���ж�T1��ʱ��Ӧ�����еķ���_____(���������ƶ�)��������ﵽƽ��ʱN2O4�����ʵ���Ϊ_____mol��
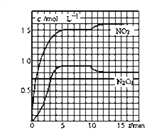
���𰸡� abd ac 0.18mol/ (L��min) 0.4 ���� 2.2mol
��������I����1��a�������¶ȿ����������Ӱٷ�������Ч��ײ�Ĵ������ӣ���ӿ췴Ӧ���ʣ���a��ȷ��b������ѹǿ��������λ����������Ŀ����ӿ췴Ӧ���ʣ���b��ȷ��c��ʹ�ô��������ͷ�Ӧ�Ļ�ܣ��ӿ췴Ӧ���ʣ�����Ӧ�����ƽ���������䣬��c����d���������������������Ӧ���ʣ���d��ȷ���ʴ�Ϊabd��
��2��a�������¶ȣ�ƽ�������ƶ������������������С������Ӧ����ƽ���ʱ�����̣�����ȷ��b����Ӧ����ƽ��ʱ��������Ũ�ȱ仯��֮�ȵ����������֮�ȣ������백��Ũ�ȱ仯��֮��Ϊ3��2���ʴ���c��ʹ�ô����ӿ췴Ӧ���ʣ����̷�Ӧʱ�䣬����Ӱ��ƽ���ƶ����������⣬����ȷ���ʴ�Ϊac��
������1����ͼ��֪5minʱN2O4Ũ��Ϊ0.9mol/L����ǰ5min��Ӧ��ƽ������v��N2O4��=![]() =0.18mol/��Lmin����
=0.18mol/��Lmin����
��2��T1��ʱ��Ӧ��2NO2��g��N2O4��g������5min�ﵽƽ�⣬��ʱN2O4Ũ��Ϊ0.9mol/L��NO2Ũ��Ϊ1.5mol/L����ѧƽ�ⳣ��K=![]() =
=![]() =0.4��
=0.4��
��3����ʼʱ��������г���3.6molNO2��2.0molN2O4����ʱQc=![]() =0.31��K����Ӧ������У�
=0.31��K����Ӧ������У�
��ת������������Ϊx��������ʽ��
2NO2��g��N2O4��g��
cʼ��1.81.0
cת��2xx
cƽ��1.8-2x1.0+x
��ͬ�¶��£�K���䣬��:![]() �T0.4����x=0.1����ƽ��ʱN2O4�����ʵ���Ϊ��1+0.1��mol/L��2L=2.2mol��
�T0.4����x=0.1����ƽ��ʱN2O4�����ʵ���Ϊ��1+0.1��mol/L��2L=2.2mol��


 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A. ����Ԫ�ع��ɵĹ��ۻ���������еĻ�ѧ�����Ǽ��Թ��ۼ�
B. ֻ�ɷǽ���Ԫ����ɵĻ������п��������ӻ�����
C. ���н���Ԫ�صĻ�����������ӻ�����
D. �����⻯��������Ƿ��ӣ��������ֻ���ڹ��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�У�����A���������Ҫ�ɷ֡�
![]()
��ش�
��1����ɫ����E�Ļ�ѧʽ____________��
��2��д��A---B�Ļ�ѧ����ʽ_____________________��
��3��д��C---D����Һ�з���������ԭ��Ӧ�����ӷ���ʽ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��һ����Ҫ�Ļ���ԭ�ϣ��������ʼ�ת����ϵ����ͼ��

��ش�
��1��D�й����ŵ�������_____________��
��2��A��B�ķ�Ӧ������________________��
A��ȡ����ӦB���ӳɷ�Ӧ C��������Ӧ D����ԭ��Ӧ
��3��д��A��C��Ӧ�Ļ�ѧ����ʽ_______________________��
��4��ij��X��B��ͬϵ�������̼�����������Ϊ36:7����ѧ������������ơ���ȡ��֧�Թܣ��ֱ����������ˮ��ʵ��������������£�
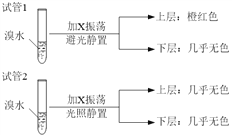
�й�X��˵����ȷ����_______________________��
A����ͬ�����£�X���ܶȱ�ˮС
B��X��ͬ���칹�干��6��
C��X����Br2�����ӳɷ�Ӧʹ��ˮ��ɫ
D��������Թ�2�е��л������ϲ㻹���²㣬��ͨ����ˮȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�뽺�������ص���
A. ���м���±��������
B. ���Ȼ�����Һ�е�������������Һ���ֺ��ɫ����
C. �ں����뺣�����γ�ɳ��
D. �ۿ���Ӱʱ���ӷ�ӳ������Ļ�����ԵĹ�·
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���һ�����������Ͻ�����ˮ�У��Ͻ�ȫ���ܽ⣬�õ�20 mL pH��14����Һ��Ȼ����1 mol/L������ζ���������ɳ�������������������������ϵ��ͼ��ʾ��������˵����ȷ����( )

A. ԭ�Ͻ�����Ϊ 0.92 g
B. �������������Ϊ896 mL(��״����)
C. ͼ��m��ֵΪ1.56
D. ͼ��V2��ֵΪ60
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������������ء�����˵���������
A.����һ��Ӧ��ش�ţ��Ա��⵰���ʱ���
B.���ࡢ��֬�������ʾ��ܷ���ˮ�ⷴӦ
C.���ۺ�ά���� C ������ʳƷ���ڵ�������
D.����ˮ����þ����ֹ�ڵ���ʴ��ԭ������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȩF (![]() )����Ȼ������ڹ����У���һ�ֳ��õ�ֲ���ζ�ͣ���ҵ����Ҫ�ǰ�����·�ߺϳɵģ�
)����Ȼ������ڹ����У���һ�ֳ��õ�ֲ���ζ�ͣ���ҵ����Ҫ�ǰ�����·�ߺϳɵģ�

��֪������ȩ������NaOH��Һ�����¿��Է�����Ӧ������һ���ǻ�ȩ��
![]() +
+ ![]()
![]()
![]()
��ش�
��1��D������Ϊ__________________��
��2����Ӧ�����������ڼӳɷ�Ӧ����____������ţ���
��3��д����Ӧ�۵Ļ�ѧ����ʽ��______________________________________��
��4����ʵ���������![]() �����е���Ԫ��ʱ���ǽ����е���Ԫ��ת��ΪAgCl��ɫ���������еģ�����ȷ�IJ���������__________���밴ʵ�鲽��������Ⱥ������д��ţ���
�����е���Ԫ��ʱ���ǽ����е���Ԫ��ת��ΪAgCl��ɫ���������еģ�����ȷ�IJ���������__________���밴ʵ�鲽��������Ⱥ������д��ţ���
A���μ�AgNO3��Һ B����NaOH��Һ C������ D����ϡ�����ữ
��5��E��ͬ���칹���ж��֣�����֮һ���������ࡣ����H����֪H����Է�����Ϊ32���ͷ�����G�Ƶã���Ľṹ����__________����
��6����������֪ʶ����������Ϣ��д������ϩΪԭ���Ʊ�CH3CH��CHCHO�ĺϳ�·������ͼ(���Լ���ѡ)��____________________
�ϳ�·������ͼ�����£�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�������80 g SO2���巢����������Ӧ����SO3����ʱ���ų�����98.3 kJ����֪SO2�ڴ�������ת����Ϊ80%���ݴˣ������Ȼ�ѧ����ʽ��ȷ����(����)
A. SO2(g)��1/2O2(g)![]() SO3(g)����H����98.3 kJ��mol��1
SO3(g)����H����98.3 kJ��mol��1
B. 2SO2(g)��O2(g)![]() 2SO3(l)����H����196.6 kJ��mol��1
2SO3(l)����H����196.6 kJ��mol��1
C. SO2(g)��1/2O2(g)![]() SO3(g)����H����78.64 kJ��mol��1
SO3(g)����H����78.64 kJ��mol��1
D. 2SO2(g)��O2(g)![]() 2SO3(g)����H��196.6 kJ��mol��1
2SO3(g)����H��196.6 kJ��mol��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com