
【题目】第一代半导体材料(Si. Ge等)与第二代半导体材料(GaAs、 InSb等)一起,将人类推进了信息时代。近年来,以碳化硅( SiC)、氮化镓(GaN)为代表的第三代半导体材料的出现,开辟了人类资源和能源节约型社会的新发展,也成为了科学家研究的热点。
(1)基态锗原子的价电子排布图为_____。
(2)N、P、As位于同一主族,基态氮原子的核外共有____种不同运动状态的电子,N20的空间构型为____,与P043-互为等电子体的分子有 ____(填一种即可)。
(3)酞菁钴近年来在光电材料、非线性光学材料、光动力学中的光敏剂、催化剂等方面得到广泛的应用,其结构如图所示,中心离子为钴离子。

酞菁钴中碳原子的杂化轨道类型为____;与钴离子通过配位健结合的氮原子的编号是_____。
(4)已知PH3分子的键角约为94°,而AsH3分子的键角约为91.8°,试用价层电子对互斥理论解释PH3的键角比AsH3的键角大的原因_____________________。
(5)第三周期主族元素中,按第一电离能大小排序,第一电离能在磷和铝之间的元素有______。
(6)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:

试从结构的角度分析它们熔点不同的原因___________________。
(7)磷化铝晶胞如图所示,若两个铝原子之间的最近距离为d pm,NA代表阿伏加德罗常数 的值,则磷化铝晶体的密度ρ= ____g/cm3。

【答案】 ![]() 7 直线形 CCl4(或SiF4等) sp2 1、3 P原子半径比As原子半径小,PH3分子中成键电子对间的距离较近,斥力更大 Mg、Si、S 氮化硼、氮化铝、氮化镓都是原子晶体,键长依次增大,键能依次降低,熔点依次降低
7 直线形 CCl4(或SiF4等) sp2 1、3 P原子半径比As原子半径小,PH3分子中成键电子对间的距离较近,斥力更大 Mg、Si、S 氮化硼、氮化铝、氮化镓都是原子晶体,键长依次增大,键能依次降低,熔点依次降低 ![]()
【解析】试题分析:(1)基态锗原子的价电子排布式是4S24P2;(2)有几个电子就有几种运动状态;根据N20与CO2是等电子体; P043-由5个原子构成,价电子数是32;(3) 酞菁钴中碳原子都有3个![]() 键,无孤对电子;氮原子最外层有5个电子,能形成3个共价键;(4) P原子半径比As原子半径小,PH3分子中成键电子对间的距离较近,斥力更大;(5)同周期元素从左到右第一电离能逐渐增大,ⅡA元素的S轨道全充满为稳定状态,第一电离能大于ⅢA;ⅤA的元素P轨道半充满为稳定状态,所以第一电离能大于ⅥA的元素;(6) 氮化硼、氮化铝、氮化镓都是原子晶体,键长依次增大,键能依次降低;(7)根据均摊原则计算晶胞的化学式,两个铝原子之间的最近距离为d pm,则晶胞的体积为
键,无孤对电子;氮原子最外层有5个电子,能形成3个共价键;(4) P原子半径比As原子半径小,PH3分子中成键电子对间的距离较近,斥力更大;(5)同周期元素从左到右第一电离能逐渐增大,ⅡA元素的S轨道全充满为稳定状态,第一电离能大于ⅢA;ⅤA的元素P轨道半充满为稳定状态,所以第一电离能大于ⅥA的元素;(6) 氮化硼、氮化铝、氮化镓都是原子晶体,键长依次增大,键能依次降低;(7)根据均摊原则计算晶胞的化学式,两个铝原子之间的最近距离为d pm,则晶胞的体积为![]() ,根据
,根据![]() 计算密度;
计算密度;
解析:(1)基态锗原子的价电子排布图是![]() ;(2)氮原子核外有7个电子,有7种运动状态;N20与CO2是等电子体,CO2是直线型分子,所以N20的空间构型是直线型;P043-由5个原子构成,价电子数是32,所以与P043-互为等电子体的分子有CCl4(或SiF4等);(3) 酞菁钴中碳原子都有3个
;(2)氮原子核外有7个电子,有7种运动状态;N20与CO2是等电子体,CO2是直线型分子,所以N20的空间构型是直线型;P043-由5个原子构成,价电子数是32,所以与P043-互为等电子体的分子有CCl4(或SiF4等);(3) 酞菁钴中碳原子都有3个![]() 键,无孤对电子,所以碳原子的杂化轨道类型为sp2;氮原子最外层有5个电子,能形成3个共价键,2,4两个氮原子都有3个共价键,1,3两个氮原子有4个键,所以1,3两个氮原子与钴离子通过配位健结合;(4) P原子半径比As原子半径小,PH3分子中成键电子对间的距离较近,斥力更大,所以PH3的键角比AsH3的键角大;(5)同周期元素从左到右第一电离能逐渐增大,ⅡA元素的S轨道全充满为稳定状态,第一电离能大于ⅢA;ⅤA的元素P轨道半充满为稳定状态,所以第一电离能大于ⅥA的元素;所以第三周期主族元素中,按第一电离能大小排序,第一电离能在磷和铝之间的元素有Mg、Si、S;(6) 氮化硼、氮化铝、氮化镓都是原子晶体,键长依次增大,键能依次降低,熔点依次降低;(7)根据均摊原则,晶胞中P原子数是4,Al原子数是
键,无孤对电子,所以碳原子的杂化轨道类型为sp2;氮原子最外层有5个电子,能形成3个共价键,2,4两个氮原子都有3个共价键,1,3两个氮原子有4个键,所以1,3两个氮原子与钴离子通过配位健结合;(4) P原子半径比As原子半径小,PH3分子中成键电子对间的距离较近,斥力更大,所以PH3的键角比AsH3的键角大;(5)同周期元素从左到右第一电离能逐渐增大,ⅡA元素的S轨道全充满为稳定状态,第一电离能大于ⅢA;ⅤA的元素P轨道半充满为稳定状态,所以第一电离能大于ⅥA的元素;所以第三周期主族元素中,按第一电离能大小排序,第一电离能在磷和铝之间的元素有Mg、Si、S;(6) 氮化硼、氮化铝、氮化镓都是原子晶体,键长依次增大,键能依次降低,熔点依次降低;(7)根据均摊原则,晶胞中P原子数是4,Al原子数是![]() ,所以晶胞的摩尔质量是232g/mol,两个铝原子之间的最近距离为d pm,则晶胞的体积为
,所以晶胞的摩尔质量是232g/mol,两个铝原子之间的最近距离为d pm,则晶胞的体积为![]() ,
,![]() g/cm3;
g/cm3;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图是一种可充电的锂离子电池充放电的工作示意图。放电时该电池的电极反应式为:
负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)
正极:Li1-xMnO2+xLi++xe-=LiMnO2(LiMnO2表示含锂原子的二氧化锰)
下列有关说法不正确的是

A. 该电池的反应式为Li1-xMnO2+LixC6=LiMnO2+C6
B. K与M相接时,A是阳极,发生氧化反应
C. K与N相接时,Li+由A极区迁移到B极区
D. 在整个充、放电过程中至少存在3种形式的能量转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是H2和Cl2反应生成HCl,Q=184.6 KJ,由图可知( )

A. 反应物的能量总和小于生成物的能量
B. 生成1mol HCl(g) 需要吸收92.3 KJ的热量
C. H2(g)+Cl2(g)→2HCl(g) +184.6 KJ
D. 常温下,H2(g)与Cl2(g)混合就能反应生成HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )

A. ②①③④⑤⑥ B. ⑤④②①③⑥ C. ⑤④③①②⑥ D. ⑤③②④①⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柔性电子产品因具有独特的柔性、延展性等优点在信息、医疗、能源等领域具有广泛应用前景。下图为中科院张新波课题组受中国传统书法艺术启发,直接将用毛笔书写后的纸张和锂箔作为电极材料组装成的锂空气电池。下列说法不正确的是( )
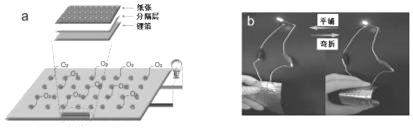
A. 纸张电极是该电池的正极
B. 锂箔电极发生的电极反应:Li﹣e-=Li+
C. 电池工作时,电子从锂箔电极经导线流向纸张电极,再从纸张电极经电解质溶液流向锂箔电极
D. 该电池具有轻型、柔性且可折叠的特点,有望应用于柔性电子器件
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图甲装置电解一定量的CuSO4溶液,M、N为惰性电极.电解过程实验数据如图乙所示.X轴表示电解过程中转移电子的物质的量,Y轴表示电解过程产生气体的总体积.则下列说法不正确的是( )

A. 若M电极材料换成Cu做电极,则电解过程中CuSO4溶液的浓度不变
B. 电解过程中N电极表面先有红色物质生成,后有气泡产生
C. Q点时M、N两电极上产生的气体总量在相同条件下体积相同
D. A点所得溶液只需加入一定量的CuO固体就可恢复到起始状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1 mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )

A. 原合金质量为 0.92 g
B. 产生氧气的体积为896 mL(标准状况下)
C. 图中m的值为1.56
D. 图中V2的值为60
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数值。下列说法正确的是
A. 标准状况下,11.2L的甲醇所含的氢原子数等于2NA
B. 25℃时,Ksp(BaSO4)=1×10-10,则BaSO4饱和和溶液中Ba2+数目为1×10-5NA
C. 常温常压下,Na2O2与H2O反应生成1molO2时,转移电子数是2 NA
D. 1L1mol·L-1AlCl3溶液中含有的Al3+数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物的1H核磁共振谱图中出现两组不同特征峰的是 ( )
A. CH3—O—CH3 B. CH3 CH2OH
C. CH3CHO D. CH3COOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com