
粗铜精炼后的阳极泥含有Cu、Au(金)和PbSO4等杂质,湿法处理阳极泥进行综合利用的流程如下:
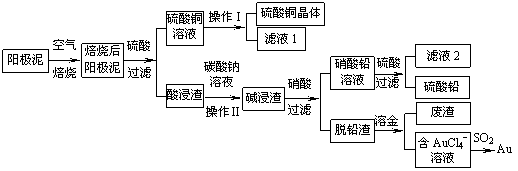

(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有: 和Cu-2e-= Cu2+。
(2)焙烧阳极泥时,为了提高焙烧效率,采取的合理措施是 ,焙烧后的阳极泥中除含金、PbSO4外,还有 (填化学式)。
(3)操作I的主要步骤为 ,操作Ⅱ的名称是 。
(4)写出用SO2还原AuCl4-的离子方程式 。
(5)为了减少废液排放、充分利用有用资源,工业上将滤液1并入硫酸铜溶液进行循环操作,请指出流程图中另一处类似的做法 。
(6)已知298K时,Ksp(PbCO3)=1.46×10-13,Ksp(PbSO4)= 1.82×10-8,用离子方程式表示加入碳酸钠溶液的作用 。
【知识点】电解原理、离子方程式的书写、物质分离和提纯的方法和基本操作综合应用
【答案解析】
Pb+SO42--2e-= PbSO4 (2)将阳极泥粉碎,逆流焙烧等;CuO
(3)蒸发浓缩、降温结晶、过滤、洗涤、干燥;过滤
(4)2AuCl4-+3SO2+6H2O=2Au+3SO42-+8Cl-+12H+ (5)滤液2可以用来溶解碱浸渣,或并入硝酸中; (6)PbSO4(s)+CO32-(aq) PbCO3(s)+SO42-(aq)
PbCO3(s)+SO42-(aq)
解析:(1)用CuSO4做电解液电解含铜、金、铅的粗铜,粗铜做阳极,电极材料放电,根据金属活动性顺序表,电极反应式为:Pb+SO42--2e-= PbSO4和Cu-2e-= Cu2+。
(2)焙烧阳极泥时,为了提高焙烧效率,采取的合理措施是将阳极泥粉碎,逆流焙烧等,焙烧后的阳极泥中除含金、PbSO4外,还有铜的产物CuO。
(3)操作I是由硫酸铜溶液得到硫酸铜晶体,主要步骤为蒸发浓缩、降温结晶、过滤、洗涤干燥;操作Ⅱ的名称是过滤;
(4)SO2做还原剂,化合价升高,对应产物为SO42-,AuCl4-化合价由+3价降为0价,根据得失电子守恒配平方程式:2AuCl4-+3SO2+6H2O=2Au+3SO42-+8Cl-+12H+
(5) 为了减少废液排放、充分利用有用资源,工业上将滤液1并入硫酸铜溶液进行循环操作,滤液2中含有大量硝酸,可以用来溶解碱浸渣,或并入硝酸中;
(6)沉淀的转化,由数据知,碳酸铅更难溶,离子方程式为:
PbSO4(s)+CO32-(aq) PbCO3(s)+SO42-(aq)
PbCO3(s)+SO42-(aq)
【思路点拨】本题考查了电解原理,涉及了电解精炼铜、化学实验基本操作、氧化还原反应的书写、沉淀的转化的综合知识,考查角度广,中等。


科目:高中化学 来源: 题型:
如右图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
A.K1闭合,铁棒上发生的反应为2H++2e=H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体

查看答案和解析>>
科目:高中化学 来源: 题型:
N A为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,11.2L的戊烷所含的分子数为0.5 NA
B.26g乙炔所含共用电子对数目为2 NA
C.标准状况下,11.2 L CCl4所含分子数为0. 5 NA
D.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
溴乙烷中含有少量乙醇杂质,下列方法中可以除去该杂质的是( )
A.加水振荡,静置分层后,用分液漏斗分离去水层
B.加入氢溴酸并加热,使乙醇转化为溴乙烷
C.加入金属钠,使乙醇发生反应而除去
D.加入浓硫酸并加热到170℃,使乙醇变成乙烯而逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是
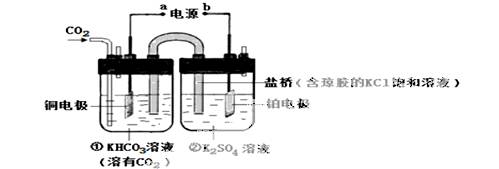
A.该过程是电能转化为化学能的过程
B.一段时间后,①池中n(KHCO3)不变
C.一段时间后,②池中溶液的pH 一定下降
D.铜电极的电极反应式为CO2+8H++8e- = CH4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
|
| A. | 1mol任何纯净物都含有相同的分子数 |
|
| B. | 1molO2中约含有6.02×1023个氧分子 |
|
| C. | 1mol氢中含有2mol氢原子 |
|
| D. | 阿伏加德罗常数就是6.02×1023mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2014年3月我国大部分地区被雾霾笼罩,PM2.5是指大气中直径小于或等于2.5微米(2.5×l0 m)的细小颗粒物,也称为可入肺颗粒物,下列有关说法中正确的是
m)的细小颗粒物,也称为可入肺颗粒物,下列有关说法中正确的是
A.大雾的形成与汽车的尾气排放没有关系
B.微粒直径为2.5微米的细小颗粒物与空气形成的分散系属于胶体
C.实施绿化工程,不可能有效地防治PM2.5污染。
D.PM2.5表面积大,能吸附大量的有毒、有害物质,吸入人体内影响健康
查看答案和解析>>
科目:高中化学 来源: 题型:
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
 某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中,测得H2的物质的量随时间变化如下图中实线所示(图中字母后数对表示对应的坐标):
某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中,测得H2的物质的量随时间变化如下图中实线所示(图中字母后数对表示对应的坐标):
回答下列问题:
(1)由图分析,在下列时间段内反应速率最快的时间段是________(填序号)。
a.0~1 min b.1~3 min c.3~8 min d.8~11 min
(2)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是________________,曲线Ⅱ改变的条件可能是________________。
(3)下列表述能表示该反应已达平衡的是________(填序号)。
a.容器内压强不再改变 b.容器内气体的密度不再改变
c.容器内气体的平均摩尔质量不再改变 d.容器内各物质的物质的量相等
d.容器内各物质的物质的量相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com