
下列叙述中正确的是( )
|
| A. | 1mol任何纯净物都含有相同的分子数 |
|
| B. | 1molO2中约含有6.02×1023个氧分子 |
|
| C. | 1mol氢中含有2mol氢原子 |
|
| D. | 阿伏加德罗常数就是6.02×1023mol﹣1 |
| 阿伏加德罗常数.. | |
| 专题: | 阿伏加德罗常数和阿伏加德罗定律. |
| 分析: | A.有些物质表示有分子构成的,如离子晶体、原子晶体; B.1mol氧气中含有阿伏伽德罗常数个氧气分子; C.使用物质的量表示粒子数目时,必须指明具体的离子名称; D.1mol粒子中含有对应的粒子数目为阿伏伽德罗常数,6.02×1023mol﹣1为阿伏伽德罗常数的近似值. |
| 解答: | 解:A.有的物质中不存在分子,如1mol碳酸钠中不存在碳酸钠分子,故A错误; B.1molO2中含有阿伏伽德罗常数个氧气分子,约含有6.02×1023个氧分子,故B正确; C.1mol氢中,没有指明是氢原子还是氢气分子,无法计算含有的氢原子数目,故C错误; D.6.02×1023mol﹣1为阿伏伽德罗常数的近似值,不是阿伏伽德罗常数,故D错误; 故选B. |
| 点评: | 本题考查了物质的量的使用方法、阿伏加德罗常数的有关计算,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确物质的量的正确使用方法及阿伏伽德罗常数与6.02×1023mol﹣1的关系. |


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
化学与科学、技术、社会、环境密切相关.下列有关说法中不正确的是
A.聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子化合物
B.煤经过气化和液化两个物理变化,可变为清洁能
C.高温能杀死流感病毒是因为构成病毒的蛋白质受热变性
D.太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
查看答案和解析>>
科目:高中化学 来源: 题型:
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示,有关该物质的说法中正确的是( )
A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C.1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol和7mol
D.该分子中的所有碳原子不可能共平面
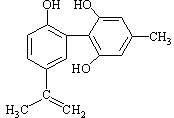
查看答案和解析>>
科目:高中化学 来源: 题型:
粗铜精炼后的阳极泥含有Cu、Au(金)和PbSO4等杂质,湿法处理阳极泥进行综合利用的流程如下:
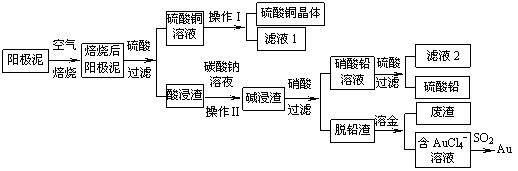

(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有: 和Cu-2e-= Cu2+。
(2)焙烧阳极泥时,为了提高焙烧效率,采取的合理措施是 ,焙烧后的阳极泥中除含金、PbSO4外,还有 (填化学式)。
(3)操作I的主要步骤为 ,操作Ⅱ的名称是 。
(4)写出用SO2还原AuCl4-的离子方程式 。
(5)为了减少废液排放、充分利用有用资源,工业上将滤液1并入硫酸铜溶液进行循环操作,请指出流程图中另一处类似的做法 。
(6)已知298K时,Ksp(PbCO3)=1.46×10-13,Ksp(PbSO4)= 1.82×10-8,用离子方程式表示加入碳酸钠溶液的作用 。
查看答案和解析>>
科目:高中化学 来源: 题型:
1mol•L﹣1硫酸溶液的含义是( )
|
| A. | 1L水中含有1mol硫酸 | B. | 1L溶液中含1mol H+ |
|
| C. | 将98g硫酸溶于1L水所配成的溶液 | D. | 指1L硫酸溶液中含有98g H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室有如下仪器①试管②烧杯③量筒④蒸发皿⑤锥形瓶⑥分流漏斗⑦蒸馏烧瓶,回答下列问题:
(1)可以直接加热的有 (填序号,下同);
(2)加热时必须垫上石棉网的有 ;
(3)使用前必须查漏的有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
由一种阳离子与两种酸根离子组成的盐为混盐。混盐CaOCl2在酸性条件下可以产生Cl2下列关于混盐CaOCl2的有关判断正确的是
A.该混盐具有和漂白粉相似的化学性质
B.该混盐的水溶液呈中性
C.该混盐与硫酸反应产生1 mol Cl2时转移2 mol电子
D.该混盐中氯元素的化合价为-1价
查看答案和解析>>
科目:高中化学 来源: 题型:
金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如下:
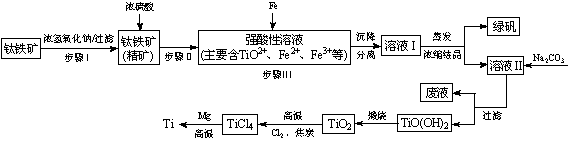
已知:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步骤I中发生反应的离子方程式: 、 。
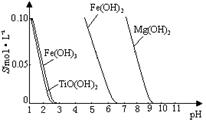 (2)已知:TiO2+易水解,只能存在于强酸性溶液中。
(2)已知:TiO2+易水解,只能存在于强酸性溶液中。
25 ℃时,难溶电解质溶解度与pH关系如右图,
TiO(OH)2溶度积Ksp=1×10-29
①步骤Ⅲ加入铁屑原因是 。
② TiO2+水解的离子方程式为 。
向溶液II中加入Na2CO3粉末的作用是 。
当溶液pH= 时,TiO(OH)2已沉淀完全。
 (3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
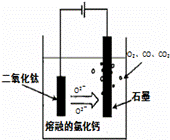
(4)电解TiO2制备钛的方法如右图所示。该方法由于具备生产过程简化、生产成本低、产品质量高、环境友好等诸多优点而引人注目。已知TiO2熔融状态下不发生电离,电解时阴极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com