
金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如下:
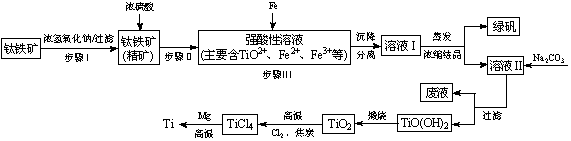
已知:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步骤I中发生反应的离子方程式: 、 。
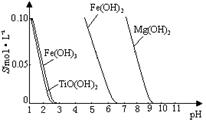 (2)已知:TiO2+易水解,只能存在于强酸性溶液中。
(2)已知:TiO2+易水解,只能存在于强酸性溶液中。
25 ℃时,难溶电解质溶解度与pH关系如右图,
TiO(OH)2溶度积Ksp=1×10-29
①步骤Ⅲ加入铁屑原因是 。
② TiO2+水解的离子方程式为 。
向溶液II中加入Na2CO3粉末的作用是 。
当溶液pH= 时,TiO(OH)2已沉淀完全。
 (3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
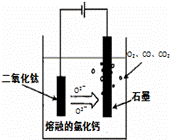
(4)电解TiO2制备钛的方法如右图所示。该方法由于具备生产过程简化、生产成本低、产品质量高、环境友好等诸多优点而引人注目。已知TiO2熔融状态下不发生电离,电解时阴极反应式为 。
【知识点】无机反应、沉淀溶解平衡计算、除杂方法、电解原理
【答案解析】(1)Al2O3+2OH-=2AlO2-+H2O(或Al2O3+2OH-+3H2O=2[Al(OH)4]-)(2分)
SiO2+2OH-=SiO32-+H2O(2分)
(2)①将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀(2分)
②TiO2++2H2O TiO(OH)2+2H+ (2分)
TiO(OH)2+2H+ (2分)
调节溶液pH值,促进TiO2+水解 (1分) 2(2分)
(3)1412 (1分)
(4)TiO2+4e-=Ti+2O2-(2分)
解析:(1)步骤I加入浓氢氧化钠后,只有Al2O3和SiO2发生反应:Al2O3+2OH-=2AlO2-+H2O(或Al2O3+2OH-+3H2O=2[Al(OH)4]-),SiO2+2OH-=SiO32-+H2O
(2)①根据溶解度曲线,Fe3+和TiO2+沉淀的PH差不多,步骤Ⅲ加入铁屑将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀;② 由沉淀的化学式写出TiO2+水解的离子方程式为:TiO2++2H2O TiO(OH)2+2H+;向溶液II中加入Na2CO3粉末的作用是调节溶液pH值,促进TiO2+水解,利于TiO2+向沉淀方向移动;溶液中的离子浓度小于10-5mol/L时,认为基本沉淀完全,根据TiO(OH)2溶度积Ksp=C(TiO2+)·C2(OH-)=1×10-29,求算溶液中的C(OH-)=10-12mol/L,PH=2;
TiO(OH)2+2H+;向溶液II中加入Na2CO3粉末的作用是调节溶液pH值,促进TiO2+水解,利于TiO2+向沉淀方向移动;溶液中的离子浓度小于10-5mol/L时,认为基本沉淀完全,根据TiO(OH)2溶度积Ksp=C(TiO2+)·C2(OH-)=1×10-29,求算溶液中的C(OH-)=10-12mol/L,PH=2;
(3)加热的温度略高于1412℃即可将Mg、MgCl2蒸馏出去,剩余Ti;
(4)电解TiO2制备钛,+4价钛在阴极得电子生成钛单质,TiO2熔融状态下不发生电离,所以,阴极的电极反应式为:TiO2+4e-=Ti+2O2-
【思路点拨】本题以制钛为工艺流程考查常见离子的除杂、转化、平衡移动等,综合性较强,考查学生的综合分析能力,难度中等。


科目:高中化学 来源: 题型:
下列叙述中正确的是( )
|
| A. | 1mol任何纯净物都含有相同的分子数 |
|
| B. | 1molO2中约含有6.02×1023个氧分子 |
|
| C. | 1mol氢中含有2mol氢原子 |
|
| D. | 阿伏加德罗常数就是6.02×1023mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,向0.1 mol·L-1CH3COOH溶液中加少量水,下列有关说法错误的是
A.溶液中所有离子的浓度都减小 B.CH3COOH的电离程度变大
C.水的电离程度变大 D.溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
 某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中,测得H2的物质的量随时间变化如下图中实线所示(图中字母后数对表示对应的坐标):
某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中,测得H2的物质的量随时间变化如下图中实线所示(图中字母后数对表示对应的坐标):
回答下列问题:
(1)由图分析,在下列时间段内反应速率最快的时间段是________(填序号)。
a.0~1 min b.1~3 min c.3~8 min d.8~11 min
(2)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是________________,曲线Ⅱ改变的条件可能是________________。
(3)下列表述能表示该反应已达平衡的是________(填序号)。
a.容器内压强不再改变 b.容器内气体的密度不再改变
c.容器内气体的平均摩尔质量不再改变 d.容器内各物质的物质的量相等
d.容器内各物质的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是
A.微粒X2-与Y2+核外电子排布相同,离子半径:X2-> Y2+
B.人们可在周期表的过渡元素中寻找催化剂、耐腐蚀和耐高温的合金材料
C.由水溶液的酸性:HCl>HF,可推断出元素的非金属性:Cl>F
D.Be元素与Al元素同处在周期表的金属与非金属的交界处,可推出:
Be(OH)2+ 2OH-=BeO22-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
我国湖南、广西等地盛产的山苍子油中柠檬醛含量很高,质量分数可达到60%-90%,柠檬醛也可以利用异戊二烯为原料人工合成,柠檬醛又可用来合成紫罗兰酮等香精香料,其合成路线如下:



已知:①
②
③同一碳原子连有两个双键结构不稳定。
试根据上述转化关系回答下列问题:
(1)写出A的结构简式 ,C的结构简式 。
(2)①对应的反应条件是 ,反应③的反应类型是 。
(3)写出B转化为柠檬醛的化学方程式 。
(4)根据反应②的反应机理写出CH3CHO与足量的HCHO反应产物的结构简式:
。
(5)检验柠檬醛中含有碳碳双键的实验方法是: 。

 (6)α-紫罗兰酮、β-紫罗兰酮有很多同分异构体,则满足下列条件的同分异构体有 种。
(6)α-紫罗兰酮、β-紫罗兰酮有很多同分异构体,则满足下列条件的同分异构体有 种。
①含有一个苯环 ②属于醇类且不能发生催化氧化反应
③核磁共振氢谱显示有5个峰
查看答案和解析>>
科目:高中化学 来源: 题型:
现有Na2SO3、Na2SO4混合物样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是
A. 将样品配制成溶液V1L,取其中25.00mL用标准KMnO4溶液滴定,消耗标准 KMnO4溶液V2mL
B. 向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为bg
C. 将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为cg
D. 将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHSO3的洗气瓶、盛有浓H2SO4的洗气瓶、盛有碱石灰的干燥管I、盛有碱石灰的干燥管II,测定干燥管I增重dg
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素Q、W、X、Y、Z的原子序数依次增大,X元素的颜色反应呈黄色,Q原子的最外层电子数是其内层电子数的2倍,W、Z原子的最外层电子数相同,Z元素的核电荷数是W的2倍,Y是地壳中含量最多的金属元素。下列说法不正确的是 ( )
A.工业上常用电解的方法制备X、Y的单质
B.元素Q和Z能形成QZ2型的共价化合物
C.原子半径的大小顺序:r(X)> r(Y)> r(W)> r(Q)
D.元素X、Y的最高价氧化物对应的水化物之间能发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com