
�ҹ����ϡ������ȵ�ʢ����ɽ������������ȩ�����ܸߣ����������ɴﵽ60%��90%������ȩҲ�������������ϩΪԭ���˹��ϳɣ�����ȩ�ֿ������ϳ�������ͪ���㾫���ϣ���ϳ�·�����£�



��֪����
��
��ͬһ̼ԭ����������˫���ṹ���ȶ���
�Ը�������ת����ϵ�ش��������⣺
��1��д��A�Ľṹ��ʽ ��C�Ľṹ��ʽ ��
��2���ٶ�Ӧ�ķ�Ӧ������ ����Ӧ�۵ķ�Ӧ������ ��
��3��д��Bת��Ϊ����ȩ�Ļ�ѧ����ʽ ��
��4�����ݷ�Ӧ�ڵķ�Ӧ����д��CH3CHO��������HCHO��Ӧ����Ľṹ��ʽ��
��
��5����������ȩ�к���̼̼˫����ʵ�鷽���ǣ� ��

 ��6������������ͪ���£�������ͪ�кܶ�ͬ���칹�壬����������������ͬ���칹���� �֡�
��6������������ͪ���£�������ͪ�кܶ�ͬ���칹�壬����������������ͬ���칹���� �֡�
�ٺ���һ������ �����ڴ����Ҳ��ܷ�����������Ӧ
�ۺ˴Ź���������ʾ��5����
��֪ʶ�㡿�л��ϳɡ��л���Ӧ���͡�ͬ���칹��
���𰸽�������1��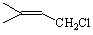 ��2�֣�
��2�֣� 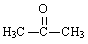 ��2�֣�
��2�֣�
��2��NaOH��ˮ��Һ������ ��2�֣� ��ȥ��Ӧ ��1�֣�
��3��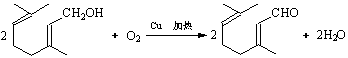 ��2�֣�
��2�֣�
��4��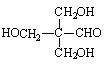 ��2�֣�
��2�֣�
��5����ʢ���������CCl4��Һ���Թ��еμ�����ȩ���ߵα�������Һ��Ϊ��ɫ���֤������ȡ��������ȩ������������Һ��ϲ�������ˮԡ�м��ȣ���ַ�Ӧ��ȡ������Һ������һ�Թ��У����μӸ������������Һ������������������Һ��ɫ����֤������ȩ���ӽṹ����̼̼˫������ ��2�֣�
��6��2 ��2�֣�
��������1����A�������ϩ���ɵ�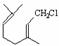 �����Կ����ɼ����ӵ�λ���ǣ�
�����Կ����ɼ����ӵ�λ���ǣ�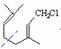 ����A�Ľṹ��ʽ��
����A�Ľṹ��ʽ�� ��ͬ����������ȩ��C�IJ���ɼ�λ�ã�
��ͬ����������ȩ��C�IJ���ɼ�λ�ã�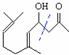 ����C�Ľṹ��ʽ��
����C�Ľṹ��ʽ��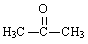 ��
��
��2�� ����ˮ������B�������ٴ���������
����ˮ������B�������ٴ���������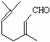 �����Ԣٶ�
�����Ԣٶ�
Ӧ�ķ�Ӧ������NaOH��ˮ��Һ�����ȣ�������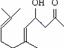 ����
����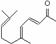 �������˴�����ȥ��Ӧ��
�������˴�����ȥ��Ӧ��
��3�����ϣ�Bת��Ϊ����ȩ�Ļ�ѧ����ʽ��

��4�����ݷ�Ӧ�ڵķ�Ӧ����д��CH3CHO��������HCHO��Ӧ����Ľṹ��ʽ��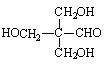 ��
��
��5������ȩ�к���ȩ�������ø�����ؼ���̼̼˫����Ҫ���ų�ȩ���ĸ��ţ�����ʵ�鷽���ǣ���ʢ���������CCl4��Һ���Թ��еμ�����ȩ���ߵα�������Һ��Ϊ��ɫ���֤������ȡ��������ȩ������������Һ��ϲ�������ˮԡ�м��ȣ���ַ�Ӧ��ȡ������Һ������һ�Թ��У����μӸ������������Һ������������������Һ��ɫ����֤������ȩ���ӽṹ����̼̼˫������
��6������������ͬ���칹���У�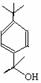 ��
��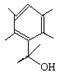 ����2��
����2��
��˼·�㲦����������ṩ��Ϣ�����л��ϳɣ��ؼ����˽ⷴӦ���������ݹ������жϷ�Ӧ���ͣ��ڣ�4�����Ѷȡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
1mol•L��1������Һ�ĺ����ǣ�������
| �� | A�� | 1Lˮ�к���1mol���� | B�� | 1L��Һ�к�1mol H+ |
| �� | C�� | ��98g��������1Lˮ����ɵ���Һ | D�� | ָ1L������Һ�к���98g H2SO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
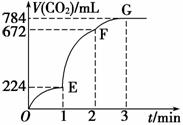 �ô�����CaCO3��100 mLϡ���ᷴӦ��ȡCO2��ʵ����̼�¼��ͼ��ʾ(CO2�����������Ϊ��״���µ����)�����з�����ȷ����
�ô�����CaCO3��100 mLϡ���ᷴӦ��ȡCO2��ʵ����̼�¼��ͼ��ʾ(CO2�����������Ϊ��״���µ����)�����з�����ȷ����
A��OE�α�ʾ��ƽ���������
B��EF�Σ��������ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ0.04 mol��L��1��min��1
C��OE��EF��FG�����У��÷�Ӧ�ö�����̼ ��ʾ��ƽ����Ӧ����֮��Ϊ2��6��7
��ʾ��ƽ����Ӧ����֮��Ϊ2��6��7
D��F���ռ�����CO2�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ��������������������ء������й�˵���в���ȷ����
A���������������̼���衢�մɺ�̼��ά�ȸ��϶��ɣ�����һ���������ǽ�������
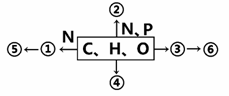 B��
B�� �Ƿ����Ծ�ʾ�ı�־
�Ƿ����Ծ�ʾ�ı�־
C�������������˵Ľ������Σ�����������͡������ķ�ɢ��������ͬ
D��ú����Ҫ�ɷ�Ϊ����̼���������ױ��ȣ������ͨ��ú�ĸ������Ƿ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ѣ�Ti��������Խ������Ϊ��������֮��ġ���������������ҵ������������Ҫ�ɷ�FeTiO3����FeO��Al2O3��SiO2�����ʣ�Ϊ��Ҫԭ��ұ�������ѣ��������Ĺ�������ͼ���£�
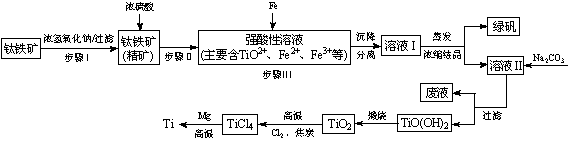
��֪��2H2SO4(Ũ)+ FeTiO3��TiOSO4 + FeSO4 + 2H2O
(1)����I�з�����Ӧ�����ӷ���ʽ�� �� ��
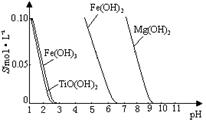 (2)��֪��TiO2����ˮ�⣬ֻ�ܴ�����ǿ������Һ�С�
(2)��֪��TiO2����ˮ�⣬ֻ�ܴ�����ǿ������Һ�С�
25 ��ʱ�����ܵ�����ܽ����pH��ϵ����ͼ��
TiO(OH)2�ܶȻ�Ksp��1��10��29
�ٲ���������мԭ���� �� ��
�� TiO2��ˮ������ӷ���ʽΪ ��
����ҺII�м���Na2CO3��ĩ�������� ��
����ҺpH= ʱ��TiO(OH)2�ѳ�����ȫ��
 (3)TiCl4��Ti��Ӧ��õ�Mg��MgCl2��Ti�Ļ����ɲ����������ķ�������õ�Ti�������±���Ϣ������ȵ��¶��Ը��� �漴�ɡ�
(3)TiCl4��Ti��Ӧ��õ�Mg��MgCl2��Ti�Ļ����ɲ����������ķ�������õ�Ti�������±���Ϣ������ȵ��¶��Ը��� �漴�ɡ�
| TiCl4 | Mg | MgCl2 | Ti | |
| �۵�/�� | ��25.0 | 648.8 | 714 | 1667 |
| �е�/�� | 136.4 | 1090 | 1412 | 3287 |
(4)���TiO2�Ʊ��ѵķ�������ͼ��ʾ���÷������ھ߱��������̼������ɱ��͡���Ʒ�����ߡ������Ѻõ�����ŵ������עĿ����֪TiO2����״̬�²��������룬���ʱ������ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
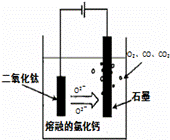
��ҵ�ϵ�ⷨ�����������Է�ˮ���õ�����Ni��ԭ����ͼ��ʾ������˵������ȷ����
��֪�� ��Ni2+����������Һ�з���ˮ��
�������ԣ�Ni2+����Ũ�ȣ���H+��Ni2+����Ũ�ȣ�
A�� ̼���Ϸ����ĵ缫��Ӧ��
4OH�� �� 4e�� == O2��+2H2O
B�� Ϊ�����Ni�IJ��ʣ�����������Ҫ���Ʒ�ˮpH
C�� �������У�B��NaCl��Һ�����ʵ���Ũ�Ƚ����ϼ�С
D�� ����ͼ��������Ĥȥ������A��B���Һϲ������ⷴӦ�ܷ���ʽ�����ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ѧһѡ��3�����ʽṹ�����ʡ���15�֣�
̼Ԫ���ǹ���������������һ��Ԫ�أ��������������ǵ�����ϢϢ��ء�
��1��������Ϊһ�������Դ�����������Ĵ������⣬C60������������ϡ���֪���ʯ�е�C��C�ļ���Ϊ154.45pm��C60��C��C����Ϊ145~140pm����ͬѧ�ݴ���ΪC60���۵���ڽ��ʯ������Ϊ�Ƿ���ȷ �������� ��
��2����ѧ�Ұ�C60�ͼز�����һ��������һ�ָ���ϩ����� �侧����ͼ��ʾ���������ڵ���ʱ��һ�ֳ����塣д����̬̼ԭ�ӵĵ����Ų�ͼ �������ʵ�Kԭ�Ӻ�C60���ӵĸ�����Ϊ ��
��3����C60��ѧ���ֺϳ���Si60��N60��C��Si��Nԭ�ӵ縺���ɴ�С��˳���� ��Si60������ÿ����ԭ��ֻ�����ڵ�3����ԭ���γɹ��ۼ�����ÿ����ԭ������㶼����8�����ȶ��ṹ����Si60�����Цм�����ĿΪ ��
��4��Fe(CO)5��һ�ֳ����������ɴ������һ�Ǧ��Ϊ���͵Ŀ��������
��д��CO��һ�ֳ����ȵ�������ӵĽṹʽ ��������ȽϷе�ߵ�Ϊ
�������ʽ����
��Fe(CO)5��һ�������·�����Ӧ��Fe(CO)5(s)=Fe(s)+5CO(g)����֪����Ӧ�����У����ѵĻ�ѧ��ֻ����λ�����ɴ��жϸ÷�Ӧ���γɵĻ�ѧ������Ϊ ��
��5��NiXO���徧���ṹΪNaCl�ͣ����ھ���ȱ�ݣ�xֵΪ0.88�������߳�Ϊ4.28��10��10m������������Niԭ��֮�����̾���Ϊ___________m����ȷ��0.01�����������е�Ni�ֱ�ΪNi2����Ni3�����˾�����Ni2����Ni3�������������Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����Т�~����ѡ�����˵Ĵ�����������ÿС��Ŀո��У����ţ���
������ ������ �۾۳� ���ܽ� ������ �����˶� �ߵ�Ӿ
�ඡ������� ���к� ��ˮ��
��1������ˮ����ǿ�⣬���Լ��������ġ�ͨ·�������������Ϊ___________��
��2������ȡ����ʱ������ʳ��ϸ��ʹ����������������̳�Ϊ_____________��
��3���ڷ���ˮ�еμӷ�̪����Һ��ɺ�ɫ��˵����֬��������ӷ�����____________��
��4�����������������м���Ũ�������Һ���������ɫ�����������������___________��
��5���ð�Ĥ����ȡ���������������к��е�NaCl��������ķ�������___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
2SO2(g)+O2(g) 2SO3(g)�ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ĸ����������Ϊ2 L�ĺ����ܱ�������Ͷ�ϣ�����ʼ���ʵ���������Ӧ���ƽ��ת�������±���ʾ��
2SO3(g)�ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ĸ����������Ϊ2 L�ĺ����ܱ�������Ͷ�ϣ�����ʼ���ʵ���������Ӧ���ƽ��ת�������±���ʾ��
| �� | �� | �� | �� | ||
| ��ʼ���ʵ��� | n(SO2)/mol | 0.40 | 0 | 0.80 | 0.02 |
| n(O2)/mol | 0.24 | 0 | 0.48 | 0.04 | |
| n(SO3)/mol | 0 | 0.40 | 0 | 0.40 | |
| ����Ӧ���ƽ��ת����% | 80 |
|
|
|
�����ж��У���ȷ����
A������SO3��ƽ��ת����Ϊ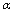 1=20% B��ƽ��ʱ������c(SO3)�Ǽ��е�2��
1=20% B��ƽ��ʱ������c(SO3)�Ǽ��е�2��
C��ƽ��ʱ��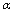 3<
3<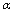 1 D�����¶��£�ƽ�ⳣ����ֵΪ400
1 D�����¶��£�ƽ�ⳣ����ֵΪ400
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com