
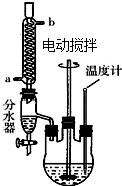
 草酸二乙酯可用于苯巴比妥等药物的中间体,实验室以草酸(HOOC-COOH)和乙醇为原料制备草酸二乙酯的实验步骤如下:
草酸二乙酯可用于苯巴比妥等药物的中间体,实验室以草酸(HOOC-COOH)和乙醇为原料制备草酸二乙酯的实验步骤如下: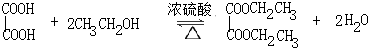 ,
, .
.分析 (1)步骤1中乙二酸与乙醇发生酯化反应生成草酸二乙酯;
(2)苯溶解有机物,与水分层;
(3)若步骤3中用NaOH溶液代替饱和碳酸氢钠溶液洗涤,酯发生水解反应;
(4)步骤4为蒸馏,需要酒精灯加热,并测定馏分的温度;
(5)使用分水器的作用是及时分离出水,从平衡移动的角度可知有利于酯的生成.
解答 解:(1)步骤1中乙二酸与乙醇发生酯化反应生成草酸二乙酯,反应为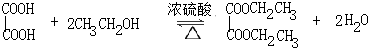 ,
,
故答案为: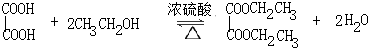 ;
;
(2)苯溶解有机物,与水分层,可知苯的作用为作溶剂,故答案为:作溶剂;
(3)若步骤3中用NaOH溶液代替饱和碳酸氢钠溶液洗涤,酯发生水解反应,发生反应为 ,
,
故答案为: ;
;
(4)步骤4为蒸馏,需要酒精灯加热,并测定馏分的温度,则还需要温度计,实验中用到的仪器还有蒸馏烧瓶、冷凝管、接液管、锥形瓶,
故答案为:温度计、酒精灯;
(5)在本题的实验中,使用分水器的作用是及时分离出水,其目的是酯化反应是可逆反应,分离出水,使反应向酯化反应方向移动,
故答案为:酯化反应是可逆反应,分离出水,使反应向酯化反应方向移动.
点评 本题考查有机物的制备实验,为高频考点,把握制备实验原理、有机物的结构与性质、实验中混合物分离提纯等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊溶液褪色 | |
| B. | 能使品红溶液褪色的不一定是SO2 | |
| C. | SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同 | |
| D. | SO2和Cl2等物质的量混合后同时通入装有湿润的有色布条的集气瓶中,漂白效果更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 正反应速率 | 逆反应速率 | |
| A | vA=2 mol/(L•min) | vB=2 mol/(L•min) |
| B | vA=2 mol/(L•min) | vC=2 mol/(L•min) |
| C | vA=1 mol/(L•min) | vB=2 mol/(L•min) |
| D | vA=1 mol/(L•min) | vC=1.5 mol/(L•min) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
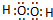 ,W第一步电离方程式为H2O2?H++HO2-.
,W第一步电离方程式为H2O2?H++HO2-.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
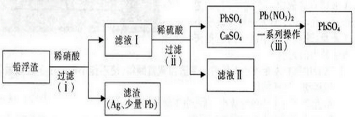
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2>△H3 | B. | △H1<△H3<△H2 | C. | △H2<△H3<△H1 | D. | △H1=△H3>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
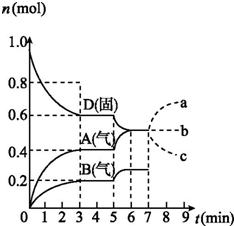 在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是( )
在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是( )| A. | 从反应开始到第一次达到平衡时,B物质的平均反应速率为0.033 3 mol/(L•min) | |
| B. | 根据右图该反应的平衡常数表达式为K=c2(A)•c(B) | |
| C. | 若在第5 min时升高温度,则该反应的正反应是吸热反应,反应的平衡常数增大,B的反应速率增大 | |
| D. | 若在第7 分钟时增加D的物质的量,A的物质的量变化情况符合a曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
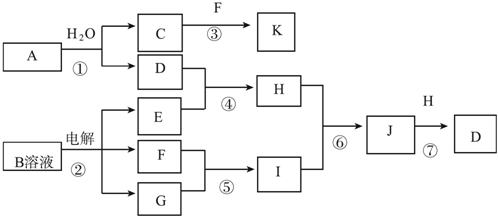
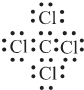 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
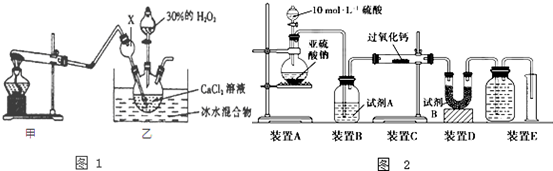
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com