
| 正反应速率 | 逆反应速率 | |
| A | vA=2 mol/(L•min) | vB=2 mol/(L•min) |
| B | vA=2 mol/(L•min) | vC=2 mol/(L•min) |
| C | vA=1 mol/(L•min) | vB=2 mol/(L•min) |
| D | vA=1 mol/(L•min) | vC=1.5 mol/(L•min) |
| A. | A | B. | B | C. | C | D. | D |
分析 化学反应到达平衡时,同一物质的正逆反应速率相等,据此分析判断.
解答 解:化学反应到达平衡时,同一物质的正逆反应速率相等.
A、A物质的正反应速率υA=2mol/(l•min),逆反应速率υB=2mol/(l•min),则逆反应速率υA=4mol/(l•min),A的正逆反应速率不相等,所以该反应未达到平衡状态,故A错误;
B、同一反应中,各物质的反应速率之比等于计量数之比,A物质的正反应速率是2mol/(L.min),C的逆反应速率为2mol/(L.min),A的逆反应速率为$\frac{3}{4}$mol/(L.min),所以A的正逆反应速率不等,故B错误;
C、同一反应中,各物质的反应速率之比等于计量数之比,A物质的正反应速率是1 mol/(L.min),B的逆反应速率为2mol/(L.min),A的逆反应速率为4mol/(L.min),所以A的正逆反应速率不等,故C错误;
D、同一反应中,各物质的反应速率之比等于计量数之比,A物质的正反应速率是1 mol/(L.min),C的逆反应速率为1.5mol/(L.min),A的逆反应速率为1mol/(L.min),所以A的正逆反应速率相等,故D正确.
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意:正逆反应速率相等是指同一物质的正逆反应速率相等.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:选择题
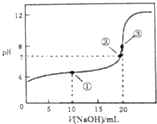 常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得曲线如图.下列说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得曲线如图.下列说法正确的是( )| A. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | ①处水的电离程度大于②处水的电离程度 | |
| C. | ②处加入的NaOH溶液恰好将CH3COOH中和 | |
| D. | ③处所示溶液:c(Na+)<c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
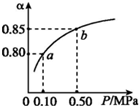 已知2A(g)+B(g)?n C(g),在密闭容器中进行,K(300℃)>K(350℃),某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示.下列说法正确的是( )
已知2A(g)+B(g)?n C(g),在密闭容器中进行,K(300℃)>K(350℃),某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A. | 该反应正反应是吸热反应 | |
| B. | 反应温度升高,A的转化率增大 | |
| C. | 平衡状态由a变到b时,化学平衡常数K(A)小于K(B) | |
| D. | 容器内气体的平均相对分子质量不变,说明反应达到化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
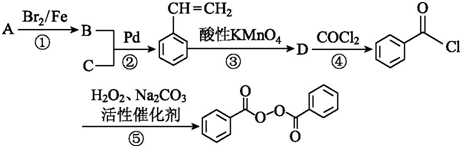
 ;
;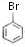 +CH2=CH2$\stackrel{Pd}{→}$
+CH2=CH2$\stackrel{Pd}{→}$ +HBr;
+HBr;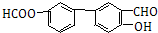 (苯环上基团位置可换);
(苯环上基团位置可换); )
)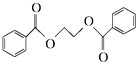 的流程图,无机物任选,注明反应条件.
的流程图,无机物任选,注明反应条件.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列问题(相关回答均用元素符号表示):
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列问题(相关回答均用元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
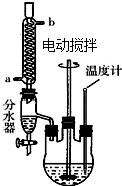 草酸二乙酯可用于苯巴比妥等药物的中间体,实验室以草酸(HOOC-COOH)和乙醇为原料制备草酸二乙酯的实验步骤如下:
草酸二乙酯可用于苯巴比妥等药物的中间体,实验室以草酸(HOOC-COOH)和乙醇为原料制备草酸二乙酯的实验步骤如下: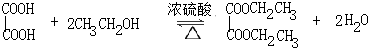 ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.48L | B. | 5.6L | C. | 6.72L | D. | 8.96L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com