
 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下:分析 短周期元素中,A的单质是密度最小的物质,则A为H元素;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,则B为Na;C的原子最外层电子数是其内层电子数的三倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;D与B(Na)同周期,该周期中D的简单离子半径最小,则D为Al;B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分,则E为Cl,Y为NaClO;F元素最高正价与最低负价的代数和为4,则F为S元素,据此解答.
解答 解:短周期元素中,A的单质是密度最小的物质,则A为H元素;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,则B为Na;C的原子最外层电子数是其内层电子数的三倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;D与B(Na)同周期,该周期中D的简单离子半径最小,则D为Al;B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分,则E为Cl,Y为NaClO;F元素最高正价与最低负价的代数和为4,则F为S元素.
(1)两种均含H、Na、O、S四种元素的化合物为NaHSO4、NaHSO3,在溶液中相互反应的离子方程式为:H++HSO3-=SO2↑+H2O,
故答案为:H++HSO3-=SO2↑+H2O;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大,故离子半径:S2->Cl->Al3+,
故答案为:S2->Cl->Al3+;
(3)向Fe和Al单质组成的混合物中,加入足量稀硫酸,固体全部溶解.向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体为氧化铁,经称量发现氧化铁的质量和原混合物的质量恰好相等,所以铝的质量相当于氧元素的质量,则原混合物中Al单质的质量分数等于氧化铁中O元素的质量分数=$\frac{16×3}{56×2+16×3}$×100%=30%,
故答案为:30%;
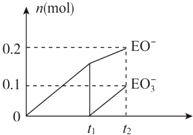
(4)根据图象知,次氯酸根离子的物质的量为0.2mol,氯酸根离子的物质的量为0.1mol,所以次氯酸根离子的物质的量与氯酸根离子的物质的量之比为2:1,根据得失电子守恒知,氯气和氢氧化钙的反应方程式为:10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O;
故答案为:10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O;
(5)H、Na形成的化合物NaHBA在有机合成中用途很广泛,它可以夺取很多化合物中的质子而生成相应的钠的化合物,它与乙醇反应的化学方程式为:NaH+CH3CH2OH→CH3CH2ONa+H2↑,
故答案为:NaH+CH3CH2OH→CH3CH2ONa+H2↑.
点评 本题考查结构性质位置关系应用,正确推断元素是解题关键,(3)中关键是理解氧化铁中的氧元素质量相当于铝元素的质量,侧重考查学生对知识的迁移运用能力考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊溶液褪色 | |
| B. | 能使品红溶液褪色的不一定是SO2 | |
| C. | SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同 | |
| D. | SO2和Cl2等物质的量混合后同时通入装有湿润的有色布条的集气瓶中,漂白效果更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②反应均是氧化还原反应 | |
| B. | KI在整个反应过程中起催化作用 | |
| C. | KI在整个反应过程中起氧化作用 | |
| D. | “溶液突然变为蓝色,随之又很快消失”这一现象与①②的反应速率有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 项目 | 熔点/°C | 密度/ (g•cm-3) | 硬度(金刚 石为10) | 导电性 (银为100) |
| 某合金 | 2 500 | 3.00 | 7.4 | 2.3 |
| 铁 | 1 535 | 7.86 | 4.5 | 17 |
| A. | 导线 | B. | 门窗框 | C. | 炉具 | D. | 飞机外壳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 正反应速率 | 逆反应速率 | |
| A | vA=2 mol/(L•min) | vB=2 mol/(L•min) |
| B | vA=2 mol/(L•min) | vC=2 mol/(L•min) |
| C | vA=1 mol/(L•min) | vB=2 mol/(L•min) |
| D | vA=1 mol/(L•min) | vC=1.5 mol/(L•min) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,W第一步电离方程式为H2O2?H++HO2-.
,W第一步电离方程式为H2O2?H++HO2-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com