
����Ŀ�����Բ��ϲ�ҵ��21���������չ�ĸ߿Ƽ�֧����ҵ֮һ�����Բ��Ϲ㷺���ڵ�����Ϣ�����¼���������̼������Ҫ�����Ʊ����������壬��ҵ�����Ȼ�隣������̿���Ʊ��ߴ���̼���̵Ĺ����������£�
��֪�������̿�۵���Ҫ�ɷ���MnCO3����������Fe��Al��Ca��Mg��Ԫ�ء�
����ؽ���Mn+����c(Mn+) �T 0.1 mol L -1�γ�M(OH) n������pH��Χ���£�
�������� | Fe3+ | Al3+ | Fe2+ | Mg2+ | Ca2+ | Mn2+ |
��ʼ������pH | 1.5 | 3.8 | 6.3 | 9.6 | 10.6 | 8.8 |
������ȫ��pH | 2.8 | 5.2 | 8.3 | 11.6 | 12.6 | 10.8 |
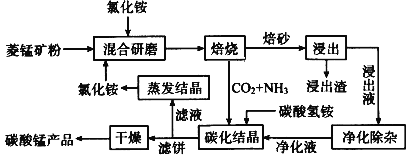
�ش��������⣺
��1����������ʱ��������Ҫ��Ӧ�Ļ�ѧ����ʽΪ_____________________________��
��2������Һ�������������������£��ټ���MnO2��Fe2+����ΪFe3+���ڵ�����ҺpH����Al3+��Fe3+��Ϊ������ȥ������pH��ΧΪ__________�ۼ���NH4F��___________����(�����ӷ���)������ȥ��
��3��̼���ᾧʱ����Ӧ�����ӷ���ʽΪ_____________________________________��
��4��̼���ᾧ�����в�����̼�����Һ����̼�������Һ���ܵ�ԭ����________________����������ѭ�����õ����ʳ����Ȼ��֮���____________��
��5���ⶨ̼���̲�Ʒ�Ĵ��ȡ�
��ȡ0.5000 g̼���̲�Ʒ����ƿ�У���25.00 mL���ᣬ���ȣ�̼����ȫ��ת��Ϊ[Mn(PO4)2]3-����ȴ�����¡���ˮϡ����100 mL���μ�2��3��ָʾ����Ȼ����Ũ��Ϊ0.2000 mol��L-1�����������[(NH4)2Fe(SO4)2]����Һ�ζ�����ӦΪ��[Mn(PO4)2]3- +Fe2+ �TMn2+ +Fe3++2PO43-�����ظ�����3�Σ���¼�������±���
�ζ����� | 0.2000 mol��L-1����������隣���Һ������mL�� | |
�ζ�ǰ | �ζ��� | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
���Ʒ�Ĵ���=__________�����ζ��յ�ʱ���ֵζ��ܼ��촦���������ݣ����õ�̼���̴ֲ�Ʒ�Ĵ���_______(����ƫ������ ƫ����������Ӱ����)��
���𰸡�MnCO3��2NH4Cl![]() MnCl2��2NH3����CO2����H2O 5.2��pH<8.8 Ca2+��Mg2+ Mn2����2HCO3��
MnCl2��2NH3����CO2����H2O 5.2��pH<8.8 Ca2+��Mg2+ Mn2����2HCO3��![]() MnCO3��CO2����H2O ̼�������ˮ��̶ȴ�̼�����Һ��c(OH-)�ϴ��ײ���Mn(OH)2���� CO2 92.00% ƫ��
MnCO3��CO2����H2O ̼�������ˮ��̶ȴ�̼�����Һ��c(OH-)�ϴ��ײ���Mn(OH)2���� CO2 92.00% ƫ��
��������
��1����������ʱ, MnCO3��NH4Cl��Ӧ������MnCl2�ȡ�
��2����Al3+��Fe3+��ȫ������pH>5.2������Mn2+���ɳ�����pH<8.8��������NH4F����Ca2+��Mg2+���ӳ�����ȥ��
��3��̼���ᾧʱ��Mn2����HCO3���ڼ��������·�Ӧ������MnCO3�ȡ�
��4��̼���ᾧ�����в�����̼�����Һ����̼�������Һ����Ҫ�Ƿ�ֹ����Mn(OH)2��������������ѭ�����õ����ʳ����Ȼ��֮���CO2��
��5�����εζ�����������隣���Һ��ƽ�����Ϊ20.00mL���ɷ�Ӧʽ���Խ������¹�ϵʽ��MnCO3����[Mn(PO4)2]3- ����[(NH4)2Fe(SO4)2]��n(MnCO3)=n(FeSO4)= 0.2000 mol��L-1��0.02L=0.004mol����Ʒ�Ĵ���Ϊ![]() �����ζ��յ�ʱ���ֵζ��ܼ��촦���������ݣ����Һ��������Ķ���ƫС���ɴ˿�ȷ����õ�̼���̴ֲ�Ʒ�Ĵ��ȱ仯��
�����ζ��յ�ʱ���ֵζ��ܼ��촦���������ݣ����Һ��������Ķ���ƫС���ɴ˿�ȷ����õ�̼���̴ֲ�Ʒ�Ĵ��ȱ仯��
��1����������ʱ����Ӧ�ķ���ʽΪMnCO3��2NH4Cl![]() MnCl2��2NH3����CO2����H2O����Ϊ��MnCO3��2NH4Cl
MnCl2��2NH3����CO2����H2O������MnCO3��2NH4Cl![]() MnCl2��2NH3����CO2����H2O��
MnCl2��2NH3����CO2����H2O��
��2����Al3+��Fe3+��ȫ������pH>5.2������Mn2+���ɳ�����pH<8.8��������NH4F���ý�Ca2+��Mg2+���ӳ�����ȥ����Ϊ��5.2��pH<8.8��Ca2+��Mg2+��
��3��̼���ᾧʱ��Mn2����HCO3���ڼ��������·�Ӧ������MnCO3�ȣ���Ӧ�����ӷ���ʽΪMn2����2HCO3��![]() MnCO3��CO2����H2O����Ϊ��Mn2����2HCO3��
MnCO3��CO2����H2O������Mn2����2HCO3��![]() MnCO3��CO2����H2O��
MnCO3��CO2����H2O��
��4��̼���ᾧ�����в�����̼�����Һ����̼�������Һ����Ҫ�Ƿ�ֹ̼�������ˮ��̶ȴ�̼�����Һ��c(OH-)�ϴ��ײ���Mn(OH)2��������������ѭ�����õ����ʳ����Ȼ��֮���CO2����Ϊ��̼�������ˮ��̶ȴ�̼�����Һ��c(OH-)�ϴ��ײ���Mn(OH)2������CO2��
��5�����εζ�����������隣���Һ��ƽ�����Ϊ20.00mL���ɷ�Ӧʽ���Խ������¹�ϵʽ��MnCO3����[Mn(PO4)2]3- ����[(NH4)2Fe(SO4)2]��n(MnCO3)=n(FeSO4)= 0.2000 mol��L-1��0.02L=0.004mol����Ʒ�Ĵ���Ϊ![]() = 92.00%����Ϊ��92.00%�����ζ��յ�ʱ���ֵζ��ܼ��촦���������ݣ����Һ��������Ķ���ƫС����õ�̼���̴ֲ�Ʒ�Ĵ���ƫ�͡���Ϊ��ƫ�͡�
= 92.00%����Ϊ��92.00%�����ζ��յ�ʱ���ֵζ��ܼ��촦���������ݣ����Һ��������Ķ���ƫС����õ�̼���̴ֲ�Ʒ�Ĵ���ƫ�͡���Ϊ��ƫ�͡�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Y�Ǻϳ����ϡ�ҽҩ��ũҩ��Ⱦ�ϵ���Ҫ�м��壬����X��һ�������ºϳɣ�

����˵������ȷ���ǣ� ��
A.Y�������ֹ�����
B.��X��ȡY�Ĺ����пɵõ��Ҵ�
C.һ�������£�Y�ܷ����Ӿ۷�Ӧ�����۷�Ӧ
D.�����ʵ�����X��Y�ֱ���NaOH ��Һ��Ӧ���������NaOH�����ʵ���֮��Ϊ3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����練Ӧ��CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g) +HCl(g)����һ��ѹǿ�£�����=
CH2=CHCH2Cl(g) +HCl(g)����һ��ѹǿ�£�����=![]() ���ܱ������г����������ϩ��ͼ�ױ�ʾƽ��ʱ����ϩ���������(��) ���¶�(T)���� �Ĺ�ϵ��ͼ�ұ�ʾ�淴Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ��������˵���������
���ܱ������г����������ϩ��ͼ�ױ�ʾƽ��ʱ����ϩ���������(��) ���¶�(T)���� �Ĺ�ϵ��ͼ�ұ�ʾ�淴Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ��������˵���������

A. ͼ���У���2>1
B. ͼ���У�A�߱�ʾ�淴Ӧ��ƽ�ⳣ��
C. �¶�T1����=2ʱ��Cl2��ת����Ϊ50%
D. ���ں��ݾ���װ���н���������Ӧ���ﵽƽ��ʱ��װ���ڵ�����ѹǿ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��X��Y��Z��W�����ڱ��е����λ����ͼ��ʾ������X��Y��W������������֮��Ϊ15��Z��X���������������2������˵����ȷ����
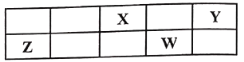
A.ԭ�Ӱ뾶��r(Z)��r(W)��r(Y)��r(X)B.X���⻯��ķе�һ����Y���⻯��ķе��
C.һ�������£�Z�����û���XD.X��YԪ�صĵ��ʾ�ֻ��2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ѷ�������ͨ����������Һ�У���Һ�ɻ�ɫ��Ϊdz��ɫ���������ֱ�Ϊ��ɫ����ʱ�������Ȼ�����Һ����������ɫ������������һϵ�б仯�����У����ձ���ԭ���ǣ� ��
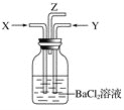
A.SO2B.NO3-C.Fe3+D.Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2��CH4���������Ʊ��ϳ������Լ���ȼ��Σ��������Ҫ�����壬�䷴Ӧ����ʾ��ͼ���£�
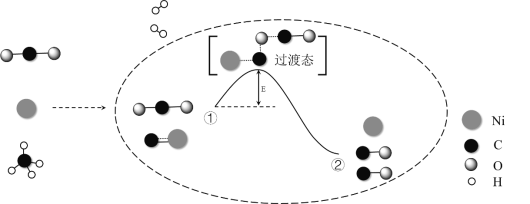
����˵������ȷ����
A. �ϳ�������Ҫ�ɷ�ΪCO��H2
B. �١��ڼ���̼�����Ķ��ѣ�����̼�������γ�
C. �١�����������
D. Ni�ڸ÷�Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����º�ѹ�����£�1 mol M�����1 mol N�������ܱ������з�����Ӧ: M(g) +3N(g)2Q(g)������˵�������ж���Ӧ�ﵽƽ��״̬����
A.![]() ��(M)=2
��(M)=2![]() ��(Q)B.c(N):c(Q)=3:2
��(Q)B.c(N):c(Q)=3:2
C.M������������ٷ����仯D.���������ܶȲ��ٷ����仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ijˮ��ҺM�д��ڵ������У�Na+��A2-��HA-��H+��OH-�����ڵķ�����H2O��H2A��
��������ش��������⣺
��д����H2A�ĵ��뷽��ʽ___��
������ҺM��2mol/LNaHA��Һ��2mol/LNaOH��Һ�������϶��ã�����ҺM��pH___7������>����<������=��������ҺM�и�����Ũ�ȹ�ϵ��ȷ����___��
A��c(Na+)>c(A2-)>c(H+)>c(OH-)
B��c(HA-)+c(H2A)+c(H+)=c(OH-)
C��c(A2-)+c(HA-)+c(H2A)=1mol/L
D��c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʯ��ʯī��Ϊ̼��ͬ�������壬��������������ʱȼ������һ����̼������������ʱ���ȼ�����ɶ�����̼����Ӧ�зų���������ͼ��ʾ��
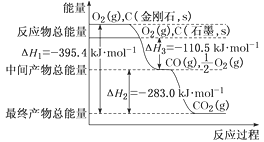
��1����ͨ��״���£����ʯ��ʯī��Ƚϣ�___(�������ʯ������ʯī��)���ȶ���
��2����֪��N2��O2�����л�ѧ���ļ��ֱܷ���946kJ��mol��1��497kJ��mol��1��N2(g)��O2(g)=2NO(g) ��H����180.0kJ��mol��1��NO�����л�ѧ���ļ���Ϊ___kJ��mol��1��
��3���ۺ������й���Ϣ����д����CO��ȥNO���Ȼ�ѧ����ʽ��___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com