
【题目】现有VL浓度为0.5mol·L-1的盐酸,现欲将此盐酸浓度增大1倍,以下方法最宜采用的是( )
A.加热浓缩到溶液体积为![]() L
L
B.加入10mol/L盐酸0.1VL,再稀释至1.5VL
C.加入0.05mol/L盐酸0.125VL
D.标准状况下通入11.2L氯化氢气体
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。下列有关说法正确的是 ( )
A. 由反应可确定:氧化产物是HClO4
B. 由非金属性Cl>S,可推知酸性HClO3>H2SO4
C. 若化学计量数a=8,b=3,则该反应转移电子数为8e-
D. 若该反应所得lmol混合气体质量为45g,则反应可表示为:3HClO3 = 2O2↑+ C12↑+ HClO4 + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的含有Al3+、Mg2+、Ba2+的混合溶液中逐滴加入NaOH和Na2SO4的混合溶液(除上述离子外,其他离子不与所加试剂反应,假设Al3+、Mg2+结合OH-的能力相同),产生沉淀的物质的量与所加溶液的体积的关系如图所示。下列说法正确的是:
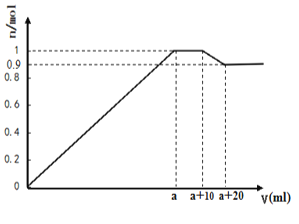
A. 当a<V<a+10时,不再生成难溶物
B. 上述含Al3+、Mg2+、Ba2+的混合溶液中3c(Al3+)+2c(Mg2+)=c(Ba2+)
C. 上述含Al3+、Mg2+、Ba2+的混合溶液中n(Al3+) = 0.2mol
D. NaOH和Na2SO4的混合溶液中c(NaOH)>c(Na2SO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.12 g铁粉加入25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是
A. 铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变B. Fe2+和Fe3+物质的量之比为5∶1
C. 往溶液中滴入无色KSCN溶液,显红色D. 氧化产物和还原产物的物质的量之比为2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超细氧化铝是一种重要的功能陶瓷原料。
Ⅰ、(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3,该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式为________________________________________________。
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100 mL pH为2、浓度约为0.1 mol·L-1的NH4Al(SO4)2溶液,配制过程中须称量NH4Al(SO4)2·12H2O固体_________g;
(3)在0.1 mol·L-1 NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液pH变化的关系见如图:
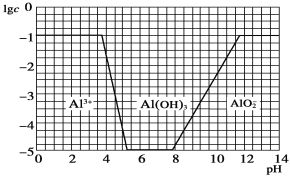
用NaOH溶液调节(2)中溶液pH至7,该过程中发生反应的离子方程式有_______________________、_______________________。
Ⅱ、从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程:
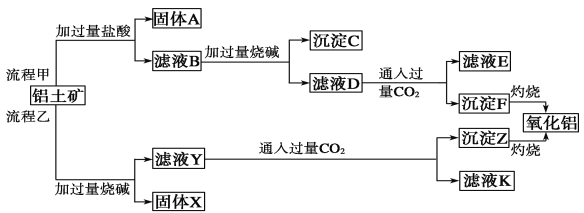
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为_________________________。
(2)流程乙向滤液Y中通入足量CO2的离子方程式为_____________________。
(3)滤液E、K中溶质的主要成分是__________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有BaCl2和NaCl的混合溶液aL,将它均分成两份,一份滴加稀硫酸,使Ba2+完全沉淀,另一份滴加AgNO3,使Cl-完全沉淀,反应中消耗xmol H2SO4、ymol AgNO3。据此得知原溶液中c(Na+)/mol·L -1为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X(g)+Y(g)![]() nZ(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( B )
nZ(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( B )
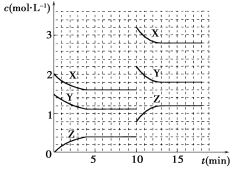
A. 反应方程式中n=1
B. 10 min时,曲线发生变化的原因是升高温度
C. 10 min时,曲线发生变化的原因是增大压强
D. 0~5 min内,用X表示的反应速率为v(X)=0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)1mol Na2O2固体与水完全反应时转移的电子数_____________,反应的离子方程式为________________。
(2)工业上由辉铜矿生产铜的主要反应为:Cu2S+O2![]() 2Cu+SO2,该反应中被还原的元素是__________(填元素符号)。
2Cu+SO2,该反应中被还原的元素是__________(填元素符号)。
(3)反应(2)中产生的SO2尾气可用NaOH溶液吸收,若用1L 1mol/L的NaOH溶液吸收标准状况下22.4L SO2,反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使甲基橙变红色的溶液:Na+、Cu2+、ClO-、Cl-
B. 0.1 mol·L-1 Na2CO3溶液:K+、AlO![]() 、Cl-、SO42-
、Cl-、SO42-
C. 0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:H+、Al3+、Cl-、NO![]()
D. KW/c(H+)=0.1 mol·L-1的溶液中:Ca2+、NH4+、CH3COO-、HCO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com