
【题目】超细氧化铝是一种重要的功能陶瓷原料。
Ⅰ、(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3,该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式为________________________________________________。
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100 mL pH为2、浓度约为0.1 mol·L-1的NH4Al(SO4)2溶液,配制过程中须称量NH4Al(SO4)2·12H2O固体_________g;
(3)在0.1 mol·L-1 NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液pH变化的关系见如图:
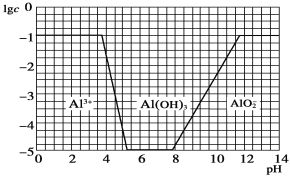
用NaOH溶液调节(2)中溶液pH至7,该过程中发生反应的离子方程式有_______________________、_______________________。
Ⅱ、从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程:
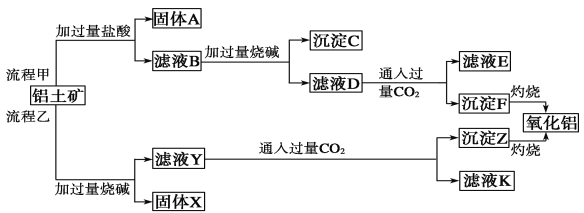
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为_________________________。
(2)流程乙向滤液Y中通入足量CO2的离子方程式为_____________________。
(3)滤液E、K中溶质的主要成分是__________(填化学式)。
【答案】2NH4AlO(OH)HCO3![]() Al2O3+2NH3↑+3H2O+2CO2↑ 4.5 NH4++OH-=NH3·H2O Al3++3OH-=Al(OH)3↓ Al2O3+6H+=2Al3++3H2O CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- NaHCO3
Al2O3+2NH3↑+3H2O+2CO2↑ 4.5 NH4++OH-=NH3·H2O Al3++3OH-=Al(OH)3↓ Al2O3+6H+=2Al3++3H2O CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- NaHCO3
【解析】
Ⅰ、(1)根据原子守恒可知NH4AlO(OH)HCO3热分解的化学反应方程式为2NH4AlO(OH)HCO3![]() Al2O3+2NH3↑+3H2O+2CO2↑;
Al2O3+2NH3↑+3H2O+2CO2↑;
(2)由物质的量浓度的定义式可知m[NH4Al(SO4)212H2O]=nM=cVM=0.1mol/L×0.1L×453g/mol=4.53g,由于托盘天平的精确度为0.1g,故为4.5g;
(3)由图象可知,开始阶段c(Al3+)没变化,是由于OH-跟H+反应;而后c(Al3+)降低,生成Al(OH)3沉淀,是由于OH-跟Al3+反应;Al3+完全沉淀后,调节pH至7,OH-跟NH4+反应,发生的化学反应方程式为:NH4++OH-=NH3·H2O、Al3++3OH-=Al(OH)3↓;
Ⅱ、(1)流程甲加入盐酸,Al2O3与稀盐酸反应,离子方程式为:Al2O3+6H+=2Al3++3H2O;
(2)流程乙中滤液Y为偏铝酸钠溶液,向其中通入足量CO2,化学反应方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,离子方程式:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;
(3)滤液Y和D为偏铝酸钠溶液,通入过量的二氧化碳反应的化学方程式为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,因此滤液E、K中溶质的主要成分是NaHCO3。


科目:高中化学 来源: 题型:
【题目】化工生产是指对原料进行化学加工,最终获得有价值的产品的生产过程。某研究小组利用含硫酸亚铁和硫酸铜的工业废料制备铁红(氧化铁)和硫酸铵晶体。流程如图:
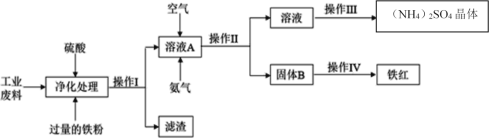
请回答下列问题:
(1)操作I的名称_____,操作Ⅲ的名称____。
(2)滤渣的成分为_____。
(3)请写出溶液A中反应的离子方程式___。在标准状况下,转移0.4NA个电子时,通入的空气体积为_____。
(4)测定废料中硫酸铜的质量分数:称取ag废料样品,将操作I得到的滤渣用足量的稀硫酸溶解、过滤、洗涤、干燥,称得固体的质量为b g,则废料中硫酸铜的质量分数____(写出表达式)。
(5)向工业废料溶液中加入足量的酸性高锰酸钾,写出有关的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G各物质间的关系如下图所示,其中B、D为气体单质。则下列说法错误的是

A.已知C的浓溶液在催化剂存在的条件下加热,能与B反应生成D,由此可以推断B的氧化性比MnO2强
B.反应②的离子方程式为![]()
C.新配制的F溶液一般需要加入铁屑和稀盐酸,前者用于防止Fe2+被空气氧化成Fe3+,后者可抑制Fe2+的水解
D.若反应①在常温下进行,则1molA在反应中能转移1mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃、101 kPa时,强酸与强碱的稀溶液中发生中和反应的中和热为57.3 kJ·mol-1,则下列描述正确的是
A. KOH(aq)+![]() H2SO4(aq)===
H2SO4(aq)===![]() K2SO4(aq)+H2O(1) ΔH=-57.3 kJ·mol-1
K2SO4(aq)+H2O(1) ΔH=-57.3 kJ·mol-1
B. NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(1) ΔH=+57.3 kJ·mol-1
C. H2SO4和Ca(OH)2反应的中和热为ΔH=2×(-57.3) kJ·mol-1
D. 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.10 | 0.09 |
② | 800 | 0.20 | 0.20 | 0.10 |
③ | 800 | 0.20 | 0. 30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法错误的是
A. 实验①中,若5min时测得n(M) =0.05mol,则0至5min时间内,用N表示的平均反应速率v(N) =0.01 mol/( L·min)
B. 实验②中,该反应的平衡常数K= 1.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.06
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有VL浓度为0.5mol·L-1的盐酸,现欲将此盐酸浓度增大1倍,以下方法最宜采用的是( )
A.加热浓缩到溶液体积为![]() L
L
B.加入10mol/L盐酸0.1VL,再稀释至1.5VL
C.加入0.05mol/L盐酸0.125VL
D.标准状况下通入11.2L氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要配制480 mL 0.10 mol·L-1的硫酸铜溶液,实验操作步骤有:
A.在天平上称取所需硫酸铜固体,把它放在烧杯中,用适量的蒸馏水使它完全溶解并恢复至室温
B.把所得的溶液小心地转移到容量瓶中
C.继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡
E.将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)___________________。
(2)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒、药匙,还缺少的仪器是______、___________。
(3)实验过程中需用天平量取___________g无水硫酸铜。
(4)下列情况会使所配溶液浓度偏高的是(填序号)_________________。
a.某同学观察液面的情况如图所示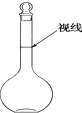
b.没进行上述的操作步骤D
c.加蒸馏水时,不慎超过了刻度线
d.砝码上沾有杂质
e.容量瓶使用前内壁沾有水珠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_______,直到因加入一滴盐酸后,溶液由________色变为________色,并________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是__________。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
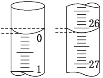
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_______mL,终点读数为_______mL,所用盐酸溶液的体积为_______mL。
(4)某学生根据3次实验分别记录有关数据如下表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1 盐酸的体积/mL | ||
滴定前读数 | 滴定后读数 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员以Zn和尖晶石型锰酸锌(ZnMn2O4)为电极材料,研制出一种水系锌离子电池。该电池的总反应方程式:xZn + Zn1xMn2O4![]() ZnMn2O4(0 < x < 1)。下列说法正确的是
ZnMn2O4(0 < x < 1)。下列说法正确的是
A. 充电时,Zn2+向ZnMn2O4电极迁移
B. 充电时,阳极反应:ZnMn2O4 2xe—=Zn1-xMn2O4+xZn2+
C. 放电时,每转移1mol e-,ZnMn2O4电极质量增加65g
D. 充放电过程中,只有Zn元素的化合价发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com