
【题目】苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
![]() +C2H5OH
+C2H5OH![]()
![]() +H2O
+H2O
已知:
颜色、状态 | 沸点(℃) | 密度(gcm﹣3) | |
苯甲酸* | 无色片状晶休 | 249 | 1.2659 |
苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
*苯甲酸在100℃会迅速升华.实验步骤如下:
①在圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按如图所示装好仪器,控制温度在6570℃加热回流2h.反应时环己烷一乙醇﹣水会形成“共沸物”(沸点62.6℃)蒸馏出来,再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇.
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞.继续加热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒人盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性.
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层.加入氯化钙,对粗产物进行蒸馏(装置如图所示),低温蒸出乙醚后,继续升温,接收210213℃的馏分.
⑤检验合格,测得产品体积为13.16mL.
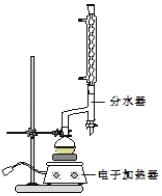
(1)在该实验中,圆底烧瓶的容积最适合的是_____(填入正确选项前的字母).
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中沸石的作用是____,使用分水器不断分离除去水的目的是_____.
(3)骤②中应控制馏分的温度在__.
A.215220℃ B.8590℃ C.7880℃ D.6570℃
(4)步骤③加入Na2CO3的作用是________;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是________.
(5)关于步骤④中的萃取分液操作叙述正确的是____.
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗下口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为____.
【答案】 C 防爆沸 使平衡不断地向正向移动 C 除去苯甲酸乙酯中的苯甲酸 在苯甲酸乙酯中有未除净的苯甲酸,受热至100℃时升华 AD 92.12%
【解析】(1)圆底烧瓶中液体的体积应该在容积1/3-2/3之间,在圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸总体积在60ml左右,所以应该用100ml容量瓶,故选C。(2)反应过程需要加热,为了防止液体爆沸加一些沸石。分离器分离出生成的水,减少生成物从而使该反应向正反应方向移动,提高转化率。(3)温度低于苯甲酸乙酯的沸点时,苯甲酸乙酯不被蒸馏出,要使苯甲酸乙酯不被蒸馏出,则温度应低于苯甲酸乙酯的沸点,所以温度应低于![]() ,但要使乙醇和环己烷蒸馏出,所以温度应高于乙醇和环己烷的沸点80.8,因此应选C。(4)加入Na2CO3,Na2CO3能和苯甲酸反应,而和苯甲酸乙酯不反应,这样可以除去苯甲酸乙酯中的苯甲酸。若Na2CO3加入不足,则会有剩余的苯甲酸,苯甲酸在
,但要使乙醇和环己烷蒸馏出,所以温度应高于乙醇和环己烷的沸点80.8,因此应选C。(4)加入Na2CO3,Na2CO3能和苯甲酸反应,而和苯甲酸乙酯不反应,这样可以除去苯甲酸乙酯中的苯甲酸。若Na2CO3加入不足,则会有剩余的苯甲酸,苯甲酸在![]() 会迅速升华,苯甲酸固体小颗粒弥漫到空气中产生白烟。(5)分液漏斗的使用方法,是在水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,将分液漏斗倒转过来,用力振摇, A正确。振摇过程应该打开上口的玻璃塞放气,B错误。分液漏斗要放到铁架台上静置,C错误。放出液体时,需将玻璃塞上的凹槽对准漏斗口上的小孔,只有这样液体才能顺利流下, D正确。正确选项为AD。(6)假如苯甲酸完全反应,则生成苯甲酸乙酯的物质的量等于苯甲酸的物质的量为12.20/122=0.1mol。而实际生成的苯甲酸乙酯的物质的量为:13.16×1.05/150=0.09212mol,因此产率为0.09212mol/0.1mol=92.12%。
会迅速升华,苯甲酸固体小颗粒弥漫到空气中产生白烟。(5)分液漏斗的使用方法,是在水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,将分液漏斗倒转过来,用力振摇, A正确。振摇过程应该打开上口的玻璃塞放气,B错误。分液漏斗要放到铁架台上静置,C错误。放出液体时,需将玻璃塞上的凹槽对准漏斗口上的小孔,只有这样液体才能顺利流下, D正确。正确选项为AD。(6)假如苯甲酸完全反应,则生成苯甲酸乙酯的物质的量等于苯甲酸的物质的量为12.20/122=0.1mol。而实际生成的苯甲酸乙酯的物质的量为:13.16×1.05/150=0.09212mol,因此产率为0.09212mol/0.1mol=92.12%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】中药麻黄成分中含有生物碱、黄酮、鞣质、挥发油、有机酚、多糖等许多成分,其中一种有机酚的结构简式如图。下列说法正确的是 ( )
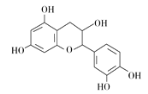
A. 分子中所有碳原子可以处于同一平面
B. 分子式为C15H12O7
C. 1 mol该有机物跟足量浓溴水反应,最多消耗5 mol Br2
D. 1 mol该有机物与NaOH溶液反应最多消耗5 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的物质的量分数(分布系数)δ随溶液pH变化的关系如图所示,下列说法正确的是
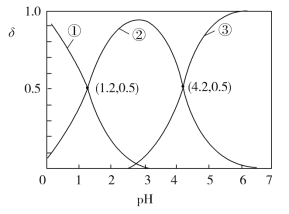
A.曲线①代表的粒子是HC2O4-
B.H2C2O4的Ka1=-1.2
C.向草酸溶液中滴加KOH溶液至pH=4.2:c(K+)<3c(C2O42-)
D.浓度均为0.01 mol·L1的草酸与KOH溶液等体积混合并充分反应得到的溶液:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下氨气能被氯气氧化生成N2,化工厂常用此法检验管道是否泄漏氯气。某探究小组在实验室对氨气与氯气反应进行了探究,回答下列问题。
Ⅰ.氨气的制备
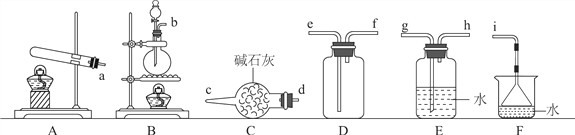
(1)氨气的发生装置可以选择上图中的________(填大写字母),反应的化学方程式为____________________________________。
(2)欲收集一瓶干燥的氨气,选择上图中的装置,按气流方向写出其接口的连接顺序:发生装置管口→________(填小写字母)。
Ⅱ.氯气与氨气的反应
室温下,用收集到的氨气按下图所示装置进行实验(实验前k1、k2关闭)。
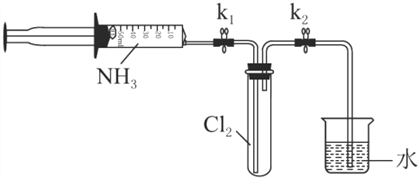
(3)打开k1,缓缓推动注射器活塞,向试管中注入约3倍于氯气体积的氨气,关闭k1,恢复室温。试管中可观察到的现象是________。发生反应的化学方程式为________。
(4)再打开k2,可观察到的现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化合物X的叙述正确的是

A. X分子只存在2个手性碳原子
B. X分子能发生氧化、取代、消去反应
C. X分子中所有碳原子可能在同一平面上
D. 1 mol X与足量NaOH溶液反应,最多消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜矿石的主要成分是Cu2O,还含有少量的Al2O3、Fe2O3和SiO2。某学习小组模拟化工生产设计了如下流程制备精铜。

已知:Cu2O + 2 H+ = Cu + Cu2+ + H2 O
回答下列问题:
(1)实际生产中,常将铜矿石粉碎的目的是______________________________。
(2)滤渣1中含有较多的铜,提纯滤渣1时反应的离子方程式为_______________________________。
(3)滤液1中铁元素的存在形式为______________(填离子符号),检验该离子的常用试剂为________________。
(4)写出加入铝粉时生成铜的化学方程式:______________________________。
(5)“电解”精炼过程中,粗铜与外接电源的___________极相连;阴极的电极反应式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯与HCl加成可能发生反应①和②,其能量与反应进程如图所示:下列说法正确的是
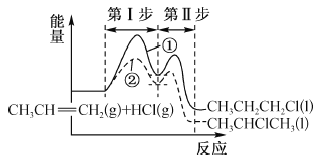
A. CH3CHClCH3 比 CH3CH2CH2Cl 稳定
B. 反应①的第I步与第Ⅱ步均放出能量
C. 反应②的第I步比第Ⅱ步反应速率快
D. 活化能反应①比②的大,反应①更易进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)广泛用于电镀、鞣制皮革、棉织品漂白后的脱氯剂等。某实验小组的同学以Na2S和SO2为原料制备Na2S2O3。回答下列问题:
(1)制备Na2S溶液
①Na2S溶液呈碱性,原因是____________________________(用离子方程式表示)。
②工业品硫化钠中常含有少量Na2SO4和Na2CO3,需进行纯化,他们将硫化钠溶于水,然后加入适量的_____________(填化学式)溶液充分搅拌并过滤,再精制得Na2S溶液。
(2)利用下图装置制备Na2S2O3
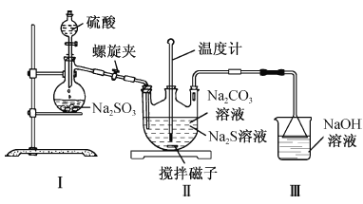
①装置Ⅰ中反应的化学方程式为___________________________________。
②实验过程中打开螺旋夹并调节螺旋夹至适当的位置,一方面使反应产生的SO2气体较均匀地通入Na2S—Na2CO3溶液中,另一方面的作用是______________________________。
③三口烧瓶内生成Na2S2O3的化学方程式为;____________________________________;装置Ⅲ的作用是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同条件下进行化学反应2A(g)=B(g)+D(g),B、D起始浓度均为0,反应物A的浓度(mol/L)随反应时间的变化情况如下表:
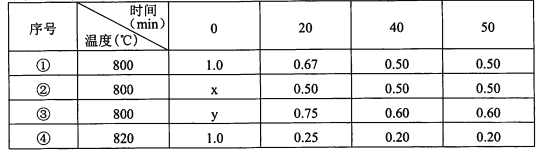
下列说法不正确的是
A.①中B在0~20 min平均反应速率为8.25xl0-3moI.L-l.min-l
B.②中K=0.25,可能使用了催化剂
C.③中y= 1.4 moI.L-l
D.比较①、④可知,该反应为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com