
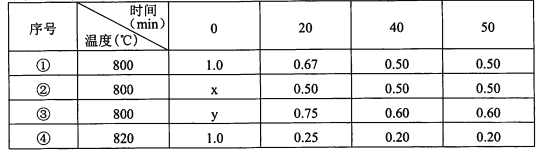
【题目】在不同条件下进行化学反应2A(g)=B(g)+D(g),B、D起始浓度均为0,反应物A的浓度(mol/L)随反应时间的变化情况如下表:
下列说法不正确的是
A.①中B在0~20 min平均反应速率为8.25xl0-3moI.L-l.min-l
B.②中K=0.25,可能使用了催化剂
C.③中y= 1.4 moI.L-l
D.比较①、④可知,该反应为吸热反应
【答案】C
【解析】
A、根据v=△c/t计算反应速率;
B、催化剂能改变反应速率,但不改变平衡;
C、根据浓度对反应速率的影响作判断;
D、根据温度对平衡移动的影响判断.
A、(1)根据v=△c/t可计算出B的反应速率为![]() =8.25xl0-3moI.L-l.min-l,故A正确;
=8.25xl0-3moI.L-l.min-l,故A正确;
B、由表中数据可知,该反应为反应前后气体分子数不变的可逆反应。实验②的平衡状态与实验①相同,但是到达所用的时间较少,说明该容器中的反应速率较大。催化剂能改变反应速率,但不改变平衡,①②平衡时浓度相同,但反应速率更快,可能使用了催化剂,故B正确;
C、比较实验①和实验③中的数据可知,在相同温度下,实验③中的A的平衡浓度大于实验①,所以反应过程中,反应速率也比实验①中的大,在相同温度下,该反应的起始浓度与平衡浓度成比例,故 ③中y= 1.2 moI.L-l,故C错误;
D、比较实验④和实验①中数据可知,温度升高,起始浓度相同,但平衡A的浓度变小,说明平衡正向移动,故可判断该反应的正反应为吸反应


科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
![]() +C2H5OH
+C2H5OH![]()
![]() +H2O
+H2O
已知:
颜色、状态 | 沸点(℃) | 密度(gcm﹣3) | |
苯甲酸* | 无色片状晶休 | 249 | 1.2659 |
苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
*苯甲酸在100℃会迅速升华.实验步骤如下:
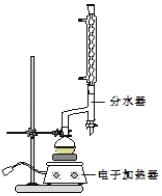
①在圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按如图所示装好仪器,控制温度在6570℃加热回流2h.反应时环己烷一乙醇﹣水会形成“共沸物”(沸点62.6℃)蒸馏出来,再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇.
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞.继续加热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒人盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性.
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层.加入氯化钙,对粗产物进行蒸馏(装置如图所示),低温蒸出乙醚后,继续升温,接收210213℃的馏分.
⑤检验合格,测得产品体积为13.16mL.
(1)在该实验中,圆底烧瓶的容积最适合的是_____(填入正确选项前的字母).
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中沸石的作用是____,使用分水器不断分离除去水的目的是_____.
(3)骤②中应控制馏分的温度在__.
A.215220℃ B.8590℃ C.7880℃ D.6570℃
(4)步骤③加入Na2CO3的作用是________;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是________.
(5)关于步骤④中的萃取分液操作叙述正确的是____.
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗下口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl-、CO![]() 、OH-三种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序中,正确的是( )
、OH-三种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序中,正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②③②①
C.①②③②④D.④②①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验法是学习化学的重要方法。
Ⅰ.海带中含有丰富的碘元素,以碘离子的形式存在。实验室里从海藻中提取碘的流程如下(已知2I-+Cl2=2Cl-+I2,碘与溴一样易溶于有机溶剂):
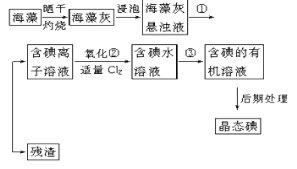
(1)实验操作①的名称:___。
(2)实验步骤②中加适量Cl2的目的__。
(3)实验步骤③提取碘的过程中,不能选用的溶剂是__。
A.苯 B.酒精 C.四氯化碳
(4)从海藻开始经过5步操作到含碘的有机溶液的实验过程中,要用到多种实验仪器。已知实验室里有坩埚、坩埚钳、烧杯、玻璃棒、酒精灯、石棉网、以及必要的夹持仪器等物品,尚缺少的玻璃仪器是___、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】査尔酮类化合物G是黄酮类药物的主要合成中间体,其中一种合成路线如下:
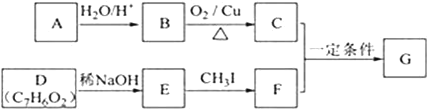
已知以下信息:
①芳香烃A的相对分子质量在100~110之间,1mol A充分燃烧可生成72g水。
②C不能发生银镜反应。
③D能发生银镜反应、可溶于饱和Na2CO3溶液。核磁共振氢谱显示有4种氢。
④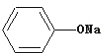 +RCH2I
+RCH2I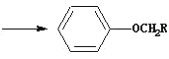
⑤RCOCH3+RˊCHO![]() RCOCH=CHRˊ
RCOCH=CHRˊ
回答下列问题:
(1)A的化学名称为_______。
(2)由B生成C的化学方程式为________。
(3)E的分子式为_______,由E生成F的反应类型为_________。
(4)G的结构简式为______。
(5)D的芳香同分异构体H既能发生银镜反应,又能发生水解反应,H在酸催化下发生水解反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下将 0. 1mol·L-1的烧碱溶液不断滴加到 10.00 mL 相同浓度的 HA 溶液中,溶液中-lgc水 (H+)与NaOH 溶液的体积关系如图所示[注:c水(H+)为溶液中水电离的(H+)],下列说法不正确的是
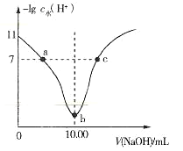
A.0.1 mol · L-1 HA 溶液pH=3
B.b 点溶液中存在:c(H+)+c(HA)=c(OH-)
C.a、b、c 三点溶液中,a 点溶液导电性最强
D.a、c 两点溶液中均存在:c(H+)+ c(Na+) = c(OH-)+ c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。完成下列问题:
(1)写出元素符号:W为________,X为_________,Y为__________,Z为__________。
(2)W2Z是由___________键组成的分子,其电子式为___________。
(3)由Y、X、W组成的物质是由_________键和__________键组成的___________化合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种高效电解质(如图所示),其中W、Y、X、Z、Q均为短周期元素,且原子序数依次增大,X和Q位于同一主族,Y和Z的原子序数之和与Q相等。下列说法正确的是

A.Q的氧化物对应水化物为强酸B.阴离子中所有原子均满足8电子稳定结构
C.元素非金属性的顺序为Z>Y>XD.W和X形成的化合物溶于水呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
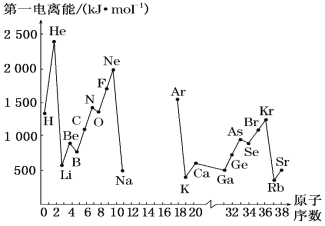
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围在哪两种元素之间为_____(填元素符号);
②图中第一电离能最小的元素在周期表中的位置是___________。
(2)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性:
元素 | Al | B | Be | C | Cl | F | Li |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
元素 | Mg | N | Na | O | P | S | Si |
电负性 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
已知:两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。
①通过分析电负性值变化规律,确定Mg元素电负性值的最小范围________;
②判断下列物质是离子化合物还是共价化合物:
A.Li3N
Ⅰ.属于离子化合物的是_____;Ⅱ.属于共价化合物的是____;请设计一个实验方案证明上述所得到的结论____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com