
����Ŀ�������½� 0. 1mol��L-1���ռ���Һ���ϵμӵ� 10.00 mL ��ͬŨ�ȵ� HA ��Һ�У���Һ��-lgcˮ ��H+����NaOH ��Һ�������ϵ��ͼ��ʾ[ע��cˮ��H+��Ϊ��Һ��ˮ����ģ�H+��],����˵������ȷ����
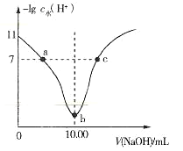
A.0.1 mol �� L-1 HA ��ҺpH=3
B.b ����Һ�д��ڣ�c��H+��+c��HA��=c��OH-��
C.a��b��c ������Һ�У�a ����Һ��������ǿ
D.a��c ������Һ�о�����:c��H+��+ c��Na+�� = c��OH-��+ c��A-��
���𰸡�C
��������
A. 0.1 molL1 HA ��Һcˮ(H+) =1��1011 molL1��c(OH��)=1��1011 molL1����c(H+) =1��103molL1�����pH=3����A��ȷ��
B. b����Һ������ΪNaA�����������غ�õ���c(H+)+c(HA)=c(OH��)����B��ȷ��
C. a��b��c ������Һ�У�a��ΪNaA��HA�����Һ��b��ΪNaA��c��ΪNaA��NaOH�����Һ�����c������Ũ�������Һ��������ǿ����C����
D. ���ݵ���غ�a��c ������Һ�о����ڣ�c(H+)+ c(Na+) = c(OH��)+ c(A��)����D��ȷ��
������������ΪC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͭ��ʯ����Ҫ�ɷ���Cu2O��������������Al2O3��Fe2O3��SiO2��ijѧϰС��ģ�⻯��������������������Ʊ���ͭ��

��֪��Cu2O + 2 H�� = Cu + Cu2�� + H2 O
�ش��������⣺
(1)ʵ�������У�����ͭ��ʯ�����Ŀ����______________________________��
(2)����1�к��н϶��ͭ���ᴿ����1ʱ��Ӧ�����ӷ���ʽΪ_______________________________��
(3)��Һ1����Ԫ�صĴ�����ʽΪ______________(�����ӷ���)����������ӵij����Լ�Ϊ________________��
(4)д����������ʱ����ͭ�Ļ�ѧ����ʽ��______________________________��
(5)����������������У���ͭ����ӵ�Դ��___________�������������ĵ缫��ӦʽΪ__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д���������ʵĽṹ��ʽ��
��1��2��4��6��������5���һ����飺________________________________��
��2��3������1����Ȳ��______________________________��
��3��1��4�����ϩ��______________________________��
��4������ϩ��___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
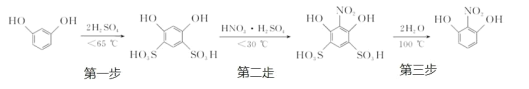
����Ŀ��������ͭ�Ǻϳ��������������в��ϩ�����������ͭ����Ҫǰ����֮һ��
��ͼ1������һ��ʵ���Һϳ�·�ߣ�
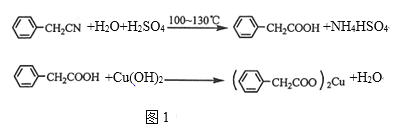
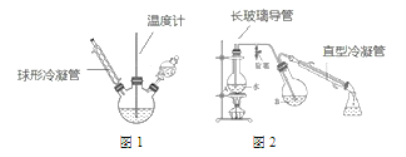
�Ʊ��������װ����ͼ2��ʾ�����Ⱥͼг�װ�õ��ԣ���
��֪����������۵�76.5�棬������ˮ��������ˮ���Ҵ���
�ش���������
��1����250mL����ƿa�м���70mL70%���ᣬ��a�е���Һ������100�棬�����μ�40g�����浽������Һ�У�Ȼ��������130�������Ӧ��
����װ���У�����b��������_______��
������c��������_________����������_______��
�۷�Ӧ��������������ˮ��ϣ���ϵIJ�����_______������ˮ��ϵ�Ŀ����______��
��2�����������п����ڷ��뱽�����Ʒ����__________������ĸ����
A ��Һ©�� B ©�� C �ձ� D ֱ�������� E ������
��3���ᴿ������ķ����ǣ���������ֲ�Ʒ���뵽______�����ܽ⣬Ȼ��_____�����____�����յõ�44g��Ʒ��������IJ�����_______��
��4������������뵽�Ҵ���ˮ�Ļ���ܼ��У�����ܽ����Cu��OH��2����30min�����ˣ���Һ����һ��ʱ�䣬����������ͭ���壬����ܼ����Ҵ���������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڲ�ͬ�����½��л�ѧ��Ӧ2A(g)=B(g)+D(g)��B��D��ʼŨ�Ⱦ�Ϊ0����Ӧ��A��Ũ��(mol/L)�淴Ӧʱ��ı仯������±���
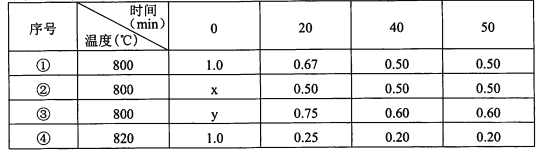
����˵������ȷ����
A.����B��0��20 minƽ����Ӧ����Ϊ8.25xl0-3moI.L-l.min-l
B.����K=0.25������ʹ���˴���
C.����y= 1.4 moI.L-l
D.�ȽϢ١��ܿ�֪���÷�ӦΪ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2-����-1,3-�������ɼ䱽�����Ȼǻ�������������ȥ��������ɡ�ԭ�����£�
�������ʵ�����������£�
���� | ��״ | �۵�/�� | ˮ���ԣ����£� |
�䱽���� | ��ɫ��״���� | 110.7 | ���� |
2-����-1,3-������ | �ۺ�ɫ��״���� | 87.8 | ���� |
�Ʊ��������£�
��һ�����ǻ�����ȡһ�������ļ䱽���ӣ���ɷ�ĩ������ƿ�У�������������Ũ���Ტ���Ͻ��裬�����¶���һ����Χ�ڷ�Ӧ 15 min����ͼ 1����
�ڶ��������������ǻ���Ӧ��������ƿ������ˮ�У������ȴ����롰���ᡱ�������¶ȼ�����15 min��������������������Ӧ������ϡ��Һת�Ƶ�Բ����ƿ B �У�Ȼ����ͼ 2 ��ʾװ�ý���ˮ���������ռ������õ� 2-����-1,3-�����Ӵ�Ʒ��
��ش��������⣺
��1���ǻ������п����¶�����ʵķ�ΧΪ������ĸ��________��
a.30 �桫60 �� b.60 �桫65 �� c.65 �桫70 �� d.70 �桫100 ��
��2�����ǻ��ڶ�λ����ԭ�ӱȽϻ��ã����ױ�ȡ�����������һ���ǻ������������ţ�-SO3H����������_______________________��
��3��������������ȡ�����ᡱ�ľ��������______________________��
��4������˵����ȷ����_______________��
a ֱ���������ڱ��п��ܻ��к�ɫ��������
b ͼ 2 �е�����������ͼ 1 �е������ܴ���
c ��ƿA�г�����������ѹ���ã����ܷ�ֹװ����ѹǿ���������¹ʣ����ܷ�ֹѹǿ��С��������
��5���������У�ˮ���������������__________________����ͨ��________�����������һ���ᴿ 2-����-1,3-�����ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ2HI(g) ![]() H2(g) +I2(g),���������ܹ�˵������ƽ��״̬����
H2(g) +I2(g),���������ܹ�˵������ƽ��״̬����
A. ����������ɫ���ٱ仯
B. �¶Ⱥ����һ��ʱ��������ѹǿ���ٱ仯
C. lmolH-H�����ɵ�ͬʱ��2molH-I������
D. �����ʵ����ʵ���Ũ��֮��Ϊ2��1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ�������һ��̫����������H2S�ֽ�װ�ã�����ԭ����ͼ��ʾ�����������������
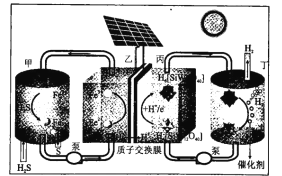
A.���������ĵ缫��ӦΪ![]()
B.����![]() �ڴ������淢���绯ѧ��Ӧ����
�ڴ������淢���绯ѧ��Ӧ����![]() ��H2
��H2
C.�����ϼ���ÿ����1molSʱͨ�����ӽ���Ĥ��H+Ϊ2mol
D.��װ��ʵ��������̫���ܼ�ӽ�H2S�ֽ�ΪS��H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����йػ�ѧ����ı�����ȷ���ǣ� ��
A.�ڻ�̬�����ԭ���У�p�����������һ������s�����������
B.��̬Feԭ�ӵļ۵��ӹ����ʾʽ��![]()
C.����Ԫ�ص縺�Աȵ�Ԫ�ش���ԭ�ӵ�һ�����ܱȵ�ԭ�ӵ�һ�����ܴ�
D.����ԭ�Ӻ�������Ų����ص㣬Cu�����ڱ�������s��Ԫ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com