
【题目】科学家合成出了一种高效电解质(如图所示),其中W、Y、X、Z、Q均为短周期元素,且原子序数依次增大,X和Q位于同一主族,Y和Z的原子序数之和与Q相等。下列说法正确的是

A.Q的氧化物对应水化物为强酸B.阴离子中所有原子均满足8电子稳定结构
C.元素非金属性的顺序为Z>Y>XD.W和X形成的化合物溶于水呈碱性
【答案】D
【解析】
4个X原子均形成2个共价键,Q形成6个共价键,X和Q位于同一主族且X的原子序数小于Q,所以X为O,Q为S,W和阴离子之间形成离子键且原子序数最小,则W为Li,2个Z均形成一个共价键且原子序数比Q小,则Z为F,Y和Z的原子序数之和与Q相等,则Y为N,综上所述,W、Y、X、Z、Q分别为:Li、N、X、F、S,据此分析解答。
A.S的氧化物对应水化物不一定为强酸,例如H2SO3是弱酸,A错误;
B.由阴离子只带一个单位负电荷可知,Y (N)原子最外层只有5+1=6个电子,B错误;
C.Z(F)、Y(N)、X(O)三者的非金属性强弱顺序为:Z(F)>X(O)>Y(N),C错误;
D.W和X形成的化合物为Li2O,Li2O溶于水生成LiOH,LiOH溶液显碱性,D正确。
答案选D。


科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)广泛用于电镀、鞣制皮革、棉织品漂白后的脱氯剂等。某实验小组的同学以Na2S和SO2为原料制备Na2S2O3。回答下列问题:
(1)制备Na2S溶液
①Na2S溶液呈碱性,原因是____________________________(用离子方程式表示)。
②工业品硫化钠中常含有少量Na2SO4和Na2CO3,需进行纯化,他们将硫化钠溶于水,然后加入适量的_____________(填化学式)溶液充分搅拌并过滤,再精制得Na2S溶液。
(2)利用下图装置制备Na2S2O3
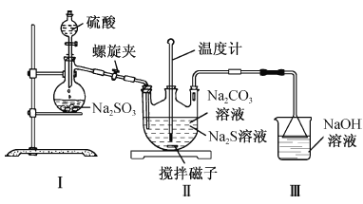
①装置Ⅰ中反应的化学方程式为___________________________________。
②实验过程中打开螺旋夹并调节螺旋夹至适当的位置,一方面使反应产生的SO2气体较均匀地通入Na2S—Na2CO3溶液中,另一方面的作用是______________________________。
③三口烧瓶内生成Na2S2O3的化学方程式为;____________________________________;装置Ⅲ的作用是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同条件下进行化学反应2A(g)=B(g)+D(g),B、D起始浓度均为0,反应物A的浓度(mol/L)随反应时间的变化情况如下表:
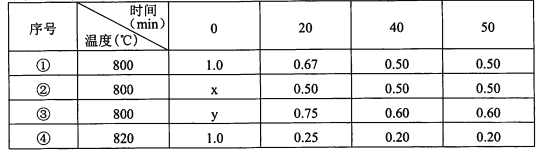
下列说法不正确的是
A.①中B在0~20 min平均反应速率为8.25xl0-3moI.L-l.min-l
B.②中K=0.25,可能使用了催化剂
C.③中y= 1.4 moI.L-l
D.比较①、④可知,该反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2HI(g) ![]() H2(g) +I2(g),下列叙述能够说明己达平衡状态的是
H2(g) +I2(g),下列叙述能够说明己达平衡状态的是
A. 混合气体的颜色不再变化
B. 温度和体积一定时,容器内压强不再变化
C. lmolH-H键生成的同时有2molH-I键断裂
D. 各物质的物质的量浓度之比为2:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家首次抓住“兔耳朵”解密催化反应“黑匣子”。图a是TiO2结构图,图b是TiO2吸附H2O后形成“兔耳朵”的结构图,图c是图b的俯视图。下列叙述错误的是
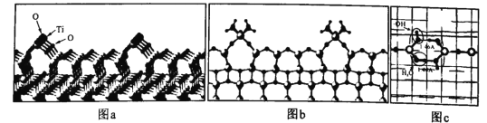
A.由图a可知,每隔4个Ti原子会有一列凸起
B.由图b可知,凸起位置上的Ti原子是反应的活性位点
C.由图c可知,水分子和羟基之间靠共价键结合
D.将CO引入体系,通过观察凸起结构变化,证实水煤气变换催化反应的发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计了一种太阳能驱动的H2S分解装置,工作原理如图所示。下列叙述错误的是
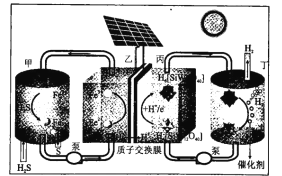
A.丙区发生的电极反应为![]()
B.丁区![]() 在催化剂表面发生电化学反应生成
在催化剂表面发生电化学反应生成![]() 和H2
和H2
C.理论上甲区每生成1molS时通过质子交换膜的H+为2mol
D.该装置实现了利用太阳能间接将H2S分解为S和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“NaH2PO2还原法”制备高纯度氢碘酸和亚磷酸钠(Na2HPO3)的工业流程如图。
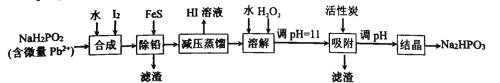
已知:25℃时,H3PO3的pKa1=1.3,pKa2=6.6。
(1)“合成”过程,主要氧化产物为H3PO3,相应的化学方程式为______________
(2)“除铅”过程,FeS除去微量Pb2+的离子方程式为______________。
(3)“减压蒸馏”过程,I-回收率为95%,则剩余固体的主要成分为____(填化学式)。
(4)“调pH=11”的作用是______________。
(5)若“结晶”前溶液中Na2HPO3的浓度为0.1mol.L-1,则“吸附”处理后,应调节溶液pH至______________(填数值)。
(6)氢碘酸也可以用“电解法”制备,装置如图所示。其中双极膜(BPM)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-;A、B为离子交换膜。
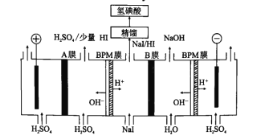
①B膜最佳应选择______________
②阳极的电极反应式是____。
③少量的I一因浓度差通过BPM膜,若撤去A膜,其缺点是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池具有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应为M1-XFeXPO4 + Li+ + e- = LiM1-XFeXPO4,其原理如图所示,下列说法正确的是( )
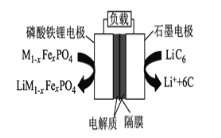
A.放电时电池的总反应为M1-XFeXPO4 + LiC6 =LiM1-XFeXPO4 + 6C
B.放电时,电流由石墨电极流向磷酸铁锂电极
C.充电时,Li+移向磷酸铁锂电极
D.充电时,石墨电极应该接到电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生产生活中应用广泛。回答下列问题:
(1)“中国制造2025”是中国政府实施制造强国战略第一个十年行动纲领。氮化铬(CrN)具有极高的硬度和力学强度、优异的抗腐蚀性能和高温稳定性能,氮化铬在现代工业中发挥更重要的作用,请写出Cr3+的外围电子排布式___;基态铬、氮原子的核外未成对电子数之比为___。
(2)过硫酸铵[(NH4)2S2O8],广泛地用于蓄电池工业、石油开采、淀粉加工、油脂工业、照相工业等,过硫酸铵中N、S、O的第一电离能由大到小的顺序为___,过硫酸铵的阳离子的空间构型为___。
(3)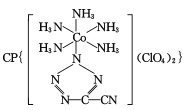 是20世纪80年代美国研制的典型钝感起爆药Ⅲ,它是由
是20世纪80年代美国研制的典型钝感起爆药Ⅲ,它是由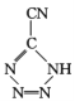 和[Co(NH3)5H2O](ClO4)3反应合成的,
和[Co(NH3)5H2O](ClO4)3反应合成的,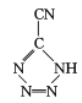 中孤电子对与π键比值为__,CP的中心Co3+的配位数为___。
中孤电子对与π键比值为__,CP的中心Co3+的配位数为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com