
【题目】氮及其化合物在生产生活中应用广泛。回答下列问题:
(1)“中国制造2025”是中国政府实施制造强国战略第一个十年行动纲领。氮化铬(CrN)具有极高的硬度和力学强度、优异的抗腐蚀性能和高温稳定性能,氮化铬在现代工业中发挥更重要的作用,请写出Cr3+的外围电子排布式___;基态铬、氮原子的核外未成对电子数之比为___。
(2)过硫酸铵[(NH4)2S2O8],广泛地用于蓄电池工业、石油开采、淀粉加工、油脂工业、照相工业等,过硫酸铵中N、S、O的第一电离能由大到小的顺序为___,过硫酸铵的阳离子的空间构型为___。
(3)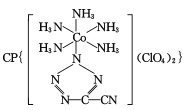 是20世纪80年代美国研制的典型钝感起爆药Ⅲ,它是由
是20世纪80年代美国研制的典型钝感起爆药Ⅲ,它是由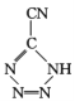 和[Co(NH3)5H2O](ClO4)3反应合成的,
和[Co(NH3)5H2O](ClO4)3反应合成的,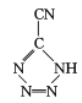 中孤电子对与π键比值为__,CP的中心Co3+的配位数为___。
中孤电子对与π键比值为__,CP的中心Co3+的配位数为___。
【答案】3d3 2:1 N>O>S 正四面体 5:4 6
【解析】
写出Cr的电子排布式、Cr和N的价电子轨道表示式,可确定Cr3+的电子排布式及未成对电子数;总的来说,元素的第一电离能与非金属性成正比,只有价电子所在轨道半满、全满或全空时出现反常;在![]() 中,中心N原子的价层电子对数为4,由此可确定其空间构型;在化合物分子中,形成共价键的原子间一定形成σ键,除σ键之外的共价键为π键;配合物中,中心离子的配位数等于配体与中心离子形成的配位键的数目。
中,中心N原子的价层电子对数为4,由此可确定其空间构型;在化合物分子中,形成共价键的原子间一定形成σ键,除σ键之外的共价键为π键;配合物中,中心离子的配位数等于配体与中心离子形成的配位键的数目。
(1)Cr的外围电子排布式为3d54s1,则Cr3+的外围电子排布式为3d3;基态铬、氮原子的核外价电子轨道表示式分别为![]() 、
、![]() ,未成对电子数之比为6:3=2:1;答案为:3d3;2:1;
,未成对电子数之比为6:3=2:1;答案为:3d3;2:1;
(2) N、S、O的非金属性O>N>S,但由于N原子的价电子处于半满状态,电子的能量低,第一电离能出现反常,所以第一电离能由大到小的顺序为N>O>S,过硫酸铵的阳离子为![]() ,中心N原子的价层电子对数为4,所以空间构型为正四面体;答案为:N>O>S;正四面体;
,中心N原子的价层电子对数为4,所以空间构型为正四面体;答案为:N>O>S;正四面体;
(3) 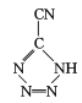 中,5个N原子含有5个孤对电子,N=C、N=N、C≡N键中分别含有1个、1个、2个π键,孤电子对与π键比值为5:4,CP的中心Co3+与配体中的N原子共形成6个配位键,所以配位数为6;答案为:5:4;6。
中,5个N原子含有5个孤对电子,N=C、N=N、C≡N键中分别含有1个、1个、2个π键,孤电子对与π键比值为5:4,CP的中心Co3+与配体中的N原子共形成6个配位键,所以配位数为6;答案为:5:4;6。


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
【题目】科学家合成出了一种高效电解质(如图所示),其中W、Y、X、Z、Q均为短周期元素,且原子序数依次增大,X和Q位于同一主族,Y和Z的原子序数之和与Q相等。下列说法正确的是

A.Q的氧化物对应水化物为强酸B.阴离子中所有原子均满足8电子稳定结构
C.元素非金属性的顺序为Z>Y>XD.W和X形成的化合物溶于水呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
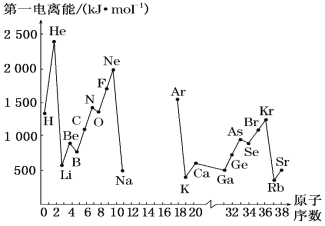
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围在哪两种元素之间为_____(填元素符号);
②图中第一电离能最小的元素在周期表中的位置是___________。
(2)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性:
元素 | Al | B | Be | C | Cl | F | Li |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
元素 | Mg | N | Na | O | P | S | Si |
电负性 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
已知:两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。
①通过分析电负性值变化规律,确定Mg元素电负性值的最小范围________;
②判断下列物质是离子化合物还是共价化合物:
A.Li3N
Ⅰ.属于离子化合物的是_____;Ⅱ.属于共价化合物的是____;请设计一个实验方案证明上述所得到的结论____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物在形成雾霾时与大气中的氨有关(如图所示)。下列有关各元素原子的说法正确的是( )

A.接近沸点的水蒸气中存在“缔合分子”,“缔合分子”内存在氢键
B.基态O2-的价电子排布式为1s22s22p6
C.![]() 中N的杂化方式为sp3,与SO3互为等电子体
中N的杂化方式为sp3,与SO3互为等电子体
D.![]() 的空间构型为正四面体,4个N-H共价键的键长相等
的空间构型为正四面体,4个N-H共价键的键长相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
![]()
![]()
![]()
![]()
![]()
![]()
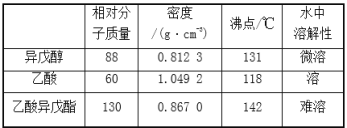
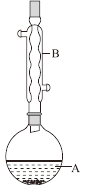
实验步骤:在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。下列问题:
(1)仪器B的名称是____________。
(2)在洗涤操作中,第一次水洗的主要目的是______,第二次水洗的主要目的是______。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是_________。
(5)实验中加入少量无水MgSO4的目的是_________。
(6)本实验的产率是________(填标号)。
a.30% b.40% c.60% d.90%
(7)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏______![]() 填“高”或“低”
填“高”或“低”![]() ,其原因是______。
,其原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:
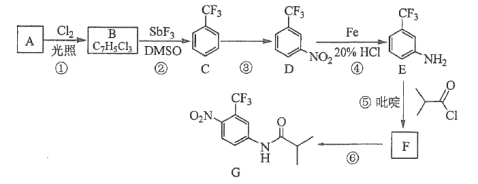
回答下列问题:
(1)A的结构简式为______,B的官能团名称:_____,C的化学名称是______。
(2)③的反应试剂和反应条件分别是_____,该反应的类型是__________。
(3)⑤的反应方程式为____________。
(4)G的分子式为__________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有______种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺的合成路线_________(其他试剂任选)。
)制备4-甲氧基乙酰苯胺的合成路线_________(其他试剂任选)。
合成路线示例:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.12 g 金刚石中含有的共用电子对数为NA
B.1 mol AlCl3在熔融时离子总数为0.4NA
C.0.2 mol MnO2与足量浓盐酸反应转移的电子数小于 0.4NA
D.1 L 0.1 mol·Lˉ1 Na2CO3溶液中含有阴离子数大于 0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近报道的一种处理垃圾酸性渗滤液并用其发电的示意图如下(注:盐桥可使原电池两极形成导电回路)。装置工作时,下列说法错误的是
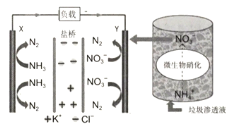
A.Y极为负极
B.化学能转变为电能
C.电子由X极沿导线流向Y极
D.Y极发生的反应为2NO![]() +10e-+12H+=N2+6H2O,周围pH增大
+10e-+12H+=N2+6H2O,周围pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热容积不变的密闭容器中发生N2(g)+3H2(g)![]() 2NH3(g) △H<0。下列各项能说明该反应已经达到反应限度的是( )
2NH3(g) △H<0。下列各项能说明该反应已经达到反应限度的是( )
A.容器内气体的总质量保持不变
B.断裂lmolN≡N键的同时断裂3molH-H键
C.容器中H2的浓度保持不变
D.v(N2):v(H2):v(NH3)=1:3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com