
【题目】在一个绝热容积不变的密闭容器中发生N2(g)+3H2(g)![]() 2NH3(g) △H<0。下列各项能说明该反应已经达到反应限度的是( )
2NH3(g) △H<0。下列各项能说明该反应已经达到反应限度的是( )
A.容器内气体的总质量保持不变
B.断裂lmolN≡N键的同时断裂3molH-H键
C.容器中H2的浓度保持不变
D.v(N2):v(H2):v(NH3)=1:3:2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氮及其化合物在生产生活中应用广泛。回答下列问题:
(1)“中国制造2025”是中国政府实施制造强国战略第一个十年行动纲领。氮化铬(CrN)具有极高的硬度和力学强度、优异的抗腐蚀性能和高温稳定性能,氮化铬在现代工业中发挥更重要的作用,请写出Cr3+的外围电子排布式___;基态铬、氮原子的核外未成对电子数之比为___。
(2)过硫酸铵[(NH4)2S2O8],广泛地用于蓄电池工业、石油开采、淀粉加工、油脂工业、照相工业等,过硫酸铵中N、S、O的第一电离能由大到小的顺序为___,过硫酸铵的阳离子的空间构型为___。
(3)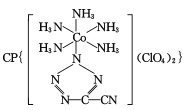 是20世纪80年代美国研制的典型钝感起爆药Ⅲ,它是由
是20世纪80年代美国研制的典型钝感起爆药Ⅲ,它是由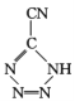 和[Co(NH3)5H2O](ClO4)3反应合成的,
和[Co(NH3)5H2O](ClO4)3反应合成的,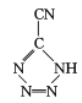 中孤电子对与π键比值为__,CP的中心Co3+的配位数为___。
中孤电子对与π键比值为__,CP的中心Co3+的配位数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,分别在起始体积均为1L的两个密闭容器中发生反应:X2(g)+3Y2(g)![]() 2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
容器 | 反应条件 | 起始物质的量/mol | 达到平衡所用时间 /min | 达到平衡过程中的能量变化 | ||
X2 | Y2 | XY3 | ||||
① | 恒容 | 1 | 3 | 0 | 10 | 放热0.1akJ |
② | 恒压 | 1 | 3 | 0 | t | 放热bkJ |
下列叙述正确的是
A. 对于上述反应,①、②中反应的平衡常数K的数值不同
B. ①中:从开始至10min内的平均反应速率υ(X2)=0.1mol/(L·min)
C. ②中:X2的平衡转化率小于10%
D. b>0.1a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列物质 ①NaCl晶体②液态SO2 ③纯醋酸 ④硫酸钡⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KNO3 ⑧NaOH溶液 ⑨氨水 请用以上物质的序号回答下列问题:
属于强电解质的是________; 属于弱电解质的是_______;在上述状态下能导电的物质是_________。
(2)化学平衡移动原理同样也适用于其它平衡,已知在氨水中存在下列平衡:NH3·H2O ![]() NH4++OH-
NH4++OH-
①向氨水中加入NH4Cl固体时,平衡____________移动,(填“向右”或“向左”),c(OH-)____(填“增大”或“减小”,下同)。
②向氨水中加入MgCl2固体时,平衡_____移动,(填“向右”或“向左”), c(NH4+)____(填“增大”或“减小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应C(s)+CO2(g)![]() 2CO(g),达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是( )
2CO(g),达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是( )
A.①②③④B.①③
C.④②D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ |
(1)表中最活泼的金属是___________,非金属性最强的元素是____________。(填写元素符号,下同)
(2)表中能形成两性氢氧化物的元素是_______________,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物对应水化物反应的化学方程式:___________、___________。
(3)⑨最高价氧化物对应水化物的电子式______________。
(4)利用下图装置来验证同主族元素非金属性的变化规律:
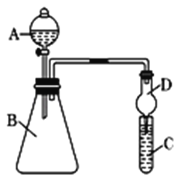
要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,应在B、D之间增加一个盛有足量____(选填下列字母:A 浓盐酸 、B 浓NaOH溶液、C 饱和Na2CO3溶液 、D 饱和NaHCO3溶液)的洗气装置.改进后C中发生反应的化学方程式是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的五种短周期主族元素,其中仅含有一种金属元素,A单质是自然界中密度最小的气体,A和D最外层电子数相同;C和B、E在周期表中均相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成A2C和A2C2两种常见的液态化合物.请回答下列问题:
(1)A元素的名称是____________,D在周期表中的位置____________,E的离子结构示意图____________。
(2)B2分子的电子式:____________,A2C的结构式:____________,A2C2中的化学键类型有:____________(极性键、非极性键或离子键)。
(3)用电子式表示D2E化合物的形成过程为______。
(4)用含A元素最简单的有机化合物与赤热的氧化铜反应生成一种单质、液态氧化物和一可以使澄清石灰水变浑浊的气体,其化学方程式为________。
(5)在100mL 18mol/L E的最高价氧化物对应水化物的溶液中加入过量的铜片,加热使之充分反应,铜片部分溶解,产生的气体在标准状况下的体积可能是________(填序号)。
a 7.32L b 6.72L c 20.16L d 30.24L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)原子半径最小的元素是___(填元素名称),写出⑧的原子结构示意图____________。
(2)最高价氧化物对应的水化物中,碱性最强的是___(用化学式回答,下同),酸性最强的是____。
(3)①与⑤形成的化合物中,化学键类型为____。
(4)⑦与⑨形成的化合物的电子式为__,②与④形成的原子个数比为1:2的化合物的结构式为__。
(5)①与②形成的一种烃,具有平面正六边形结构,相对分子质量为78,写出此烃发生取代反应的化学方程式(任写一个即可):_。
(6)为探究元素②和⑧的非金属性强弱,某同学设计了如图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。请回答:
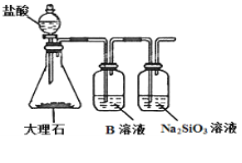
①溶液B为______,B溶液的作用是______。
②若看到_______现象,即可证明酸性_______(用化学式回答),则非金属性______(用元素符号回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空
(1)氨分子的电子式是____。化合物![]() 按系统命名法的名称为________。
按系统命名法的名称为________。
(2)写出木炭与浓硝酸加热反应的化学方程式:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com