
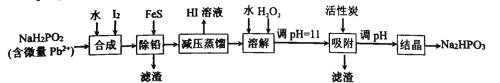
【题目】“NaH2PO2还原法”制备高纯度氢碘酸和亚磷酸钠(Na2HPO3)的工业流程如图。
已知:25℃时,H3PO3的pKa1=1.3,pKa2=6.6。
(1)“合成”过程,主要氧化产物为H3PO3,相应的化学方程式为______________
(2)“除铅”过程,FeS除去微量Pb2+的离子方程式为______________。
(3)“减压蒸馏”过程,I-回收率为95%,则剩余固体的主要成分为____(填化学式)。
(4)“调pH=11”的作用是______________。
(5)若“结晶”前溶液中Na2HPO3的浓度为0.1mol.L-1,则“吸附”处理后,应调节溶液pH至______________(填数值)。
(6)氢碘酸也可以用“电解法”制备,装置如图所示。其中双极膜(BPM)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-;A、B为离子交换膜。
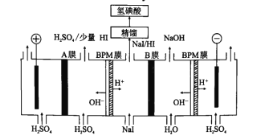
①B膜最佳应选择______________
②阳极的电极反应式是____。
③少量的I一因浓度差通过BPM膜,若撤去A膜,其缺点是______________。
【答案】NaH2PO2+I2+H2O=H3PO3+NaI+HI FeS(s)+Pb2+(aq)=Fe2+(aq)+ PbS(s) NaH2PO3 将Fe3+转化为沉淀除去,同时将NaH2PO3转换为了Na2HPO3 9.8 Na+交换膜 2H2O-4e-=O2↑+4H+ I-会在阳极失电子得到碘单质,沉积在阳极表面,损伤阳极板
【解析】
“合成”步骤,NaH2PO2和I2和水反应生成H3PO3和NaI和HI;
“除铅”步骤,FeS将Pb2+转化为PbS除去,同时得到Fe2+;
“减压蒸馏”因为HI易挥发,H3PO3和NaI反应生成HI和NaH2PO3,同时获得HI;
“溶解”阶段,H2O2将Fe2+氧化成Fe3+;
“调pH=11”将Fe3+转化为沉淀除去,同时部分NaH2PO3转换为了Na2HPO3;
“调pH”将NaH2PO3彻底转化为Na2HPO3,最后“结晶”得到Na2HPO3固体,据此分析解答。
(1) “合成”步骤,NaH2PO2和I2和水反应生成H3PO3和NaI和HI,反应方程式为:NaH2PO2+I2+H2O=H3PO3+NaI+HI,故答案为:NaH2PO2+I2+H2O=H3PO3+NaI+HI;
(2)“除铅”过程,利用沉淀转化FeS将Pb2+变成PbS,离子方程式为:FeS(s)+Pb2+(aq)=Fe2+(aq)+ PbS(s),故答案为:FeS(s)+Pb2+(aq)=Fe2+(aq)+ PbS(s);
(3)由上面的分析可知,“减压蒸馏”过程,除得到HI回收I-外,H3PO3和NaI反应有NaH2PO3生成,则剩余固体的主要成分为NaH2PO3,故答案为:NaH2PO3;
(4)“调pH=11”的作用:将Fe3+转化为沉淀除去,同时将NaH2PO3转换为了Na2HPO3,故答案为:将Fe3+转化为沉淀除去,同时将NaH2PO3转换为了Na2HPO3;
(5)H3PO3的pKa1=1.3,pKa2=6.6,说明H3PO3是二元弱酸,则HPO32-的水解常数Kh=![]() =10-7.4,
=10-7.4,![]() ,水解是微弱的,所以10-7.4
,水解是微弱的,所以10-7.4![]() ≈
≈![]() =
=![]() ,解得:c(OH-)=10-4.2mol/L,c(H+)=
,解得:c(OH-)=10-4.2mol/L,c(H+)=![]() =10-9.8mol/L,所以,pH=9.8,故答案为:9.8;
=10-9.8mol/L,所以,pH=9.8,故答案为:9.8;
(6)①从图上看,右端的BPM膜和B膜之间产生NaOH,BPM膜提供OH-,B膜最好是Na+交换膜,故答案为:Na+交换膜;
②阳极附近溶液为硫酸溶液,水电离的氢氧根失电子,故阳极的电极反应式为:2H2O-4e-=O2↑+4H+,故答案为:2H2O-4e-=O2↑+4H+;
③A膜应为阳离子交换膜,阳极产生的H+透过A膜和少量的I-得到少量的HI,若撤去A膜,I-会在阳极失电子得到碘单质,沉积在阳极表面,损伤阳极板,故答案为:I-会在阳极失电子得到单质,沉积在阳极表面,损伤阳极板。


科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl-、CO![]() 、OH-三种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序中,正确的是( )
、OH-三种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序中,正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②③②①
C.①②③②④D.④②①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。完成下列问题:
(1)写出元素符号:W为________,X为_________,Y为__________,Z为__________。
(2)W2Z是由___________键组成的分子,其电子式为___________。
(3)由Y、X、W组成的物质是由_________键和__________键组成的___________化合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种高效电解质(如图所示),其中W、Y、X、Z、Q均为短周期元素,且原子序数依次增大,X和Q位于同一主族,Y和Z的原子序数之和与Q相等。下列说法正确的是

A.Q的氧化物对应水化物为强酸B.阴离子中所有原子均满足8电子稳定结构
C.元素非金属性的顺序为Z>Y>XD.W和X形成的化合物溶于水呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的离子结构示意图为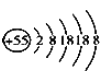 ,该离子显+1价,则该元素在周期表中的位置是( )
,该离子显+1价,则该元素在周期表中的位置是( )
A. 第5周期零族B. 第6周期第IB族
C. 第5周期第ⅦA族D. 第6周期第IA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯丁酸氮芥是氮芥类抗癌药的代表物,其合成路线:
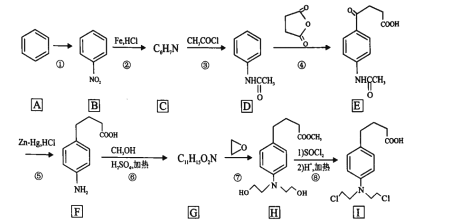
回答下列问题:
(1)反应①所需的试剂和条件是____,B中的官能团名称是_____________
(2)C的结构简式为_____________。
(3)写出具有苯环结构,既能发生银镜反应又能发生水解反应的D的同分异构体的结构简式_____________。(不考虑立体异构,只需写出3个)
(4)⑤的反应类型是_____________。
(5)写出F到G的反应方程式_____________。
(6)H到I的转化过程中是否可以将①、②两步交换顺序,说出你的理由_____________?
(7)设计由苯和![]() 制备
制备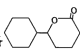 的合成路线______________无机试剂任选)。
的合成路线______________无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为ms1;B元素的原子价电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素原子有五个未成对电子。
(1)E元素原子的价电子排布式是______,在元素周期表中位置是_____,其最高价氧化物的化学式是__________。
(2)C基态原子的电子排布图为_____,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于_____键(填“σ”或“π”)。
(3)当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是_______。
(4)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的电负性由大到小的顺序是_____(用元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
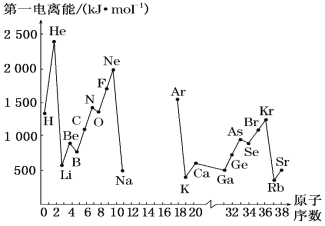
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围在哪两种元素之间为_____(填元素符号);
②图中第一电离能最小的元素在周期表中的位置是___________。
(2)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性:
元素 | Al | B | Be | C | Cl | F | Li |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
元素 | Mg | N | Na | O | P | S | Si |
电负性 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
已知:两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。
①通过分析电负性值变化规律,确定Mg元素电负性值的最小范围________;
②判断下列物质是离子化合物还是共价化合物:
A.Li3N
Ⅰ.属于离子化合物的是_____;Ⅱ.属于共价化合物的是____;请设计一个实验方案证明上述所得到的结论____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.12 g 金刚石中含有的共用电子对数为NA
B.1 mol AlCl3在熔融时离子总数为0.4NA
C.0.2 mol MnO2与足量浓盐酸反应转移的电子数小于 0.4NA
D.1 L 0.1 mol·Lˉ1 Na2CO3溶液中含有阴离子数大于 0.1 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com