
【题目】某元素的离子结构示意图为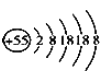 ,该离子显+1价,则该元素在周期表中的位置是( )
,该离子显+1价,则该元素在周期表中的位置是( )
A. 第5周期零族B. 第6周期第IB族
C. 第5周期第ⅦA族D. 第6周期第IA族
科目:高中化学 来源: 题型:
【题目】在一个固定容积的密闭容器中通入amolN2与bmolH2的混合气体,保持温度不变,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
(1)若反应到某时刻t时,n(N2)=9mol,n(NH3)=2mol,则a=____mol;
(2)反应达平衡时,混合气体的体积为448L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量____;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平)=____;
(4)原混合气体中,a∶b=_____;
(5)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(g) ![]() 3Z(g)△H=-akJmol﹣1(a>0)。下列说法不正确的是
3Z(g)△H=-akJmol﹣1(a>0)。下列说法不正确的是
A.升高反应温度,逆反应速率增大,正反应速率减小
B.达到化学平衡状态时,X、Y、Z的浓度不再发生变化
C.1molX和2molY完全反应生成3mol的Z,放出akJ的热量
D.0.1molX和0.2molY充分反应生成Z的物质的量一定小于0.3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家首次抓住“兔耳朵”解密催化反应“黑匣子”。图a是TiO2结构图,图b是TiO2吸附H2O后形成“兔耳朵”的结构图,图c是图b的俯视图。下列叙述错误的是
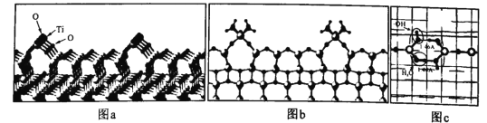
A.由图a可知,每隔4个Ti原子会有一列凸起
B.由图b可知,凸起位置上的Ti原子是反应的活性位点
C.由图c可知,水分子和羟基之间靠共价键结合
D.将CO引入体系,通过观察凸起结构变化,证实水煤气变换催化反应的发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系据此判断下列说法中正确的是
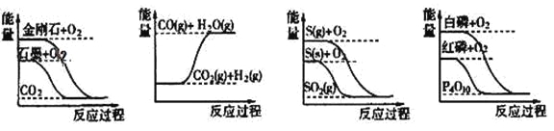
A.石墨转变为金刚石是吸热反应
B.CO(g)+H2O(g)=CO2(g)+H2(g)是吸热反应
C.相同条件下,等质量S(g)和S(s)的能量比较, S(s)较大
D.白磷比红磷稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“NaH2PO2还原法”制备高纯度氢碘酸和亚磷酸钠(Na2HPO3)的工业流程如图。
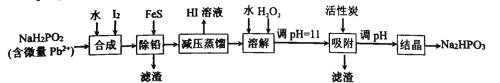
已知:25℃时,H3PO3的pKa1=1.3,pKa2=6.6。
(1)“合成”过程,主要氧化产物为H3PO3,相应的化学方程式为______________
(2)“除铅”过程,FeS除去微量Pb2+的离子方程式为______________。
(3)“减压蒸馏”过程,I-回收率为95%,则剩余固体的主要成分为____(填化学式)。
(4)“调pH=11”的作用是______________。
(5)若“结晶”前溶液中Na2HPO3的浓度为0.1mol.L-1,则“吸附”处理后,应调节溶液pH至______________(填数值)。
(6)氢碘酸也可以用“电解法”制备,装置如图所示。其中双极膜(BPM)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-;A、B为离子交换膜。
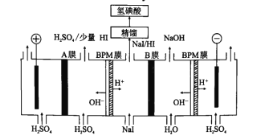
①B膜最佳应选择______________
②阳极的电极反应式是____。
③少量的I一因浓度差通过BPM膜,若撤去A膜,其缺点是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组同学利用以下实验装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答:
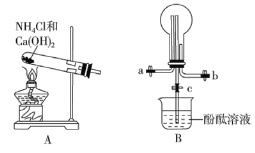
(1)实验室制备氨气的化学方程式为_________。
(2)用装置 B 收集氨气时,应选择氨气的进气口是_________ (选填“a”或“b”),并说明选择的理由是_________。
(3)打开装置B 中的止水夹 c,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是_____,请用方程式表示:_______________________________;氨气催化氧化可用于制硝酸,请写出氨气催化氧化的化学方程式 _______________________________ 。
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是_______ (填序号)。

(5)SiO2 在自然界中广泛存在,它是制备现代通讯材料________ (写该材料名称)的主要原料;以 SiO2 为原料, 在工业上制备单质硅的化学方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程。已知反应:N2(g)+3H2(g)2NH3(g)△H。有关键能数据如下:
化学键 | H-H | N-H | N≡N |
键能)kJ/mol) | 436 | 391 | 945 |
根据表中所列键能数据可得△H=____________。
(2)已知:CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H= +49.0kJ/mol
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g)△H= -192.9kJ/mol
O2(g)=CO2(g)+2H2O(g)△H= -192.9kJ/mol
已知水的气化热为44.0kJ/mol,表示氢气燃烧热的热化学方程式为______________。
(3)已知化学反应A(g)+B(g)C(g)+D(g),900℃时向一个体积为2L的密闭容器中充入0.20mol A和0.80mol B,2s时达到平衡,A的浓度变化0.05mol/L,则A的平均反应速率v(A) =________,平衡时B的转化率为____ ,C的体积百分数为_______ 。
(4)CO、H2可用于合成甲醇和甲醚,其反应为(m、n均大于![]() ):
):
反应①:CO(g)+2H2(g)CH3OH(g)△H=-m kJ/mol
反应②:2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)△H=-n kJ/mol
反应③:2CH3OH(g)CH3OCH3(g)+H2O(g)△H<0
根据上述的热化学方程式可以判断则2m_____n(填“大于”、“小于”、“等于”或“无法确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用软锰矿浆进行烟气脱硫并制备MnSO4和Mg(OH)2的工艺流程如图所示(已知软锰矿的主要成分是MnO2,还含有Fe、A1、Mg、Zn、Ni、Si等元素)。

已知:Ksp[Mg(OH)2]=4.9×10-12,Kb(NH3·H2O)=1.8×10-5。
(1)“脱硫浸锰”中软锰矿浆吸收SO2的化学方程式为______________________。
(2)向浸出液中添加适量MnO2的作用是_____________;滤渣2的主要成分是__________。
(3)“沉锰”的离子方程式为____________________________。
(4)“沉锰”过程中pH和温度对Mn2+和Mg2+沉淀率的影响如图所示。
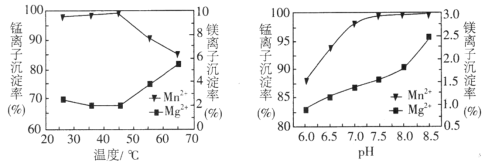
①由图可知,“沉锰”的合适条件是________________________。
②当温度高于45℃时,Mn2+和Mg2+沉淀率变化的原因是___________________________。
(5)将NH3通入0.015mol·L-1MgSO4溶液中,使Mg2+恰好完全沉淀即溶液中c(Mg2+)=1.0×10-5mol·L-1,此时溶液中NH3·H2O的物质的量浓度为________________(忽略反应前后溶液体积的变化,计算结果保留2位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com