
【题目】(1)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程。已知反应:N2(g)+3H2(g)2NH3(g)△H。有关键能数据如下:
化学键 | H-H | N-H | N≡N |
键能)kJ/mol) | 436 | 391 | 945 |
根据表中所列键能数据可得△H=____________。
(2)已知:CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H= +49.0kJ/mol
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g)△H= -192.9kJ/mol
O2(g)=CO2(g)+2H2O(g)△H= -192.9kJ/mol
已知水的气化热为44.0kJ/mol,表示氢气燃烧热的热化学方程式为______________。
(3)已知化学反应A(g)+B(g)C(g)+D(g),900℃时向一个体积为2L的密闭容器中充入0.20mol A和0.80mol B,2s时达到平衡,A的浓度变化0.05mol/L,则A的平均反应速率v(A) =________,平衡时B的转化率为____ ,C的体积百分数为_______ 。
(4)CO、H2可用于合成甲醇和甲醚,其反应为(m、n均大于![]() ):
):
反应①:CO(g)+2H2(g)CH3OH(g)△H=-m kJ/mol
反应②:2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)△H=-n kJ/mol
反应③:2CH3OH(g)CH3OCH3(g)+H2O(g)△H<0
根据上述的热化学方程式可以判断则2m_____n(填“大于”、“小于”、“等于”或“无法确定”)。
【答案】-93kJ/mol H2(g)+![]() O2(g)=H2O(l)△H -124.6kJ/mol 0.025mol·L-1·s-1 12.5% 10% 小于
O2(g)=H2O(l)△H -124.6kJ/mol 0.025mol·L-1·s-1 12.5% 10% 小于
【解析】
利用反应物键能之和减去生成物键能之和得到焓变值。利用盖斯定律计算焓变并完成热化学方程式的书写。利用“三段式”计算反应速率,转化率和体积分数。利用盖斯定律将①×2-②得到③式,再判断m和n值的相对大小,由此判断。
(1)反应:N2(g)+3H2(g)2NH3(g)△H,△H=反应物的键能之和-生成物的键能之和=945kJ/mol+3×436kJ/mol-6×391kJ/mol=-93kJ/mol;
(2)反应①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H= +49.0kJ/mol
反应②CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g)△H= -192.9kJ/mol
O2(g)=CO2(g)+2H2O(g)△H= -192.9kJ/mol
已知水的气化热为44.0 kJ/mol,可以得到反应③H2O(g)=H2O(l)△H=-44kJ/mol
③×3+(②-①)得到3H2(g)+![]() O2(g)=3H2O(l)△H=-373.9kJ/mol,氢气燃烧热的热化学方程式H2(g)+
O2(g)=3H2O(l)△H=-373.9kJ/mol,氢气燃烧热的热化学方程式H2(g)+![]() O2(g)=H2O(l)△H =-124.6kJ/mol;
O2(g)=H2O(l)△H =-124.6kJ/mol;
(3)已知化学反应A(g)+B(g)C(g)+D(g),列出“三段式”,
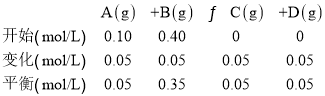
则A的平均反应速率v(A)=![]() ;
;
平衡时B的转化率为![]() ×100%=12.5%,C的体积百分数=C的物质的量分数=
×100%=12.5%,C的体积百分数=C的物质的量分数=![]() ×100%=10%;
×100%=10%;
(4)反应①:CO(g)+2H2(g)CH3OH(g)△H=-m kJ/mol
反应②:2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)△H=- nkJ/mol
反应③:2CH3OH(g)CH3OCH3(g)+H2O(g)△H<0,
反应③=反应②-①×2,则-n-2(-m)<0,2m-n<0,则2m<n 。


科目:高中化学 来源: 题型:
【题目】査尔酮类化合物G是黄酮类药物的主要合成中间体,其中一种合成路线如下:
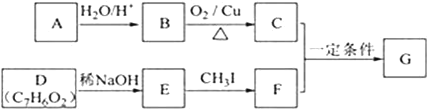
已知以下信息:
①芳香烃A的相对分子质量在100~110之间,1mol A充分燃烧可生成72g水。
②C不能发生银镜反应。
③D能发生银镜反应、可溶于饱和Na2CO3溶液。核磁共振氢谱显示有4种氢。
④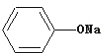 +RCH2I
+RCH2I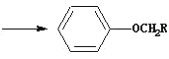
⑤RCOCH3+RˊCHO![]() RCOCH=CHRˊ
RCOCH=CHRˊ
回答下列问题:
(1)A的化学名称为_______。
(2)由B生成C的化学方程式为________。
(3)E的分子式为_______,由E生成F的反应类型为_________。
(4)G的结构简式为______。
(5)D的芳香同分异构体H既能发生银镜反应,又能发生水解反应,H在酸催化下发生水解反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的离子结构示意图为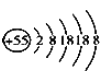 ,该离子显+1价,则该元素在周期表中的位置是( )
,该离子显+1价,则该元素在周期表中的位置是( )
A. 第5周期零族B. 第6周期第IB族
C. 第5周期第ⅦA族D. 第6周期第IA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为ms1;B元素的原子价电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素原子有五个未成对电子。
(1)E元素原子的价电子排布式是______,在元素周期表中位置是_____,其最高价氧化物的化学式是__________。
(2)C基态原子的电子排布图为_____,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于_____键(填“σ”或“π”)。
(3)当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是_______。
(4)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的电负性由大到小的顺序是_____(用元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃A,B组成的混合气体完全燃烧后得到CO2和H2O(g)的物质的量随混合烃的总物质的量的变化如图,则下列说法正确的是( )
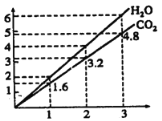
A.混合烃中n(C):n(H) = 2:5B.混合烃中一定不含有乙烯
C.若混合烃为CH4、C4H4,则体积比为4:1D.若混合烃为CH4、C3H4,则体积比为3:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
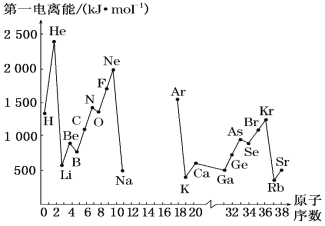
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围在哪两种元素之间为_____(填元素符号);
②图中第一电离能最小的元素在周期表中的位置是___________。
(2)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性:
元素 | Al | B | Be | C | Cl | F | Li |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
元素 | Mg | N | Na | O | P | S | Si |
电负性 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
已知:两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。
①通过分析电负性值变化规律,确定Mg元素电负性值的最小范围________;
②判断下列物质是离子化合物还是共价化合物:
A.Li3N
Ⅰ.属于离子化合物的是_____;Ⅱ.属于共价化合物的是____;请设计一个实验方案证明上述所得到的结论____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是

A. 电流由O2所在的铂电极经外电路流向另一电极
B. O2所在的铂电极处发生还原反应
C. 该电池的负极反应式为:CH3CH2OH+3H2O-12e-="=" 2CO2↑+12H+
D. 微处理器通过检测电流大小而计算出被测气体中酒精的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
![]()
![]()
![]()
![]()
![]()
![]()

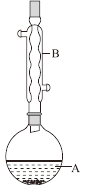
实验步骤:在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。下列问题:
(1)仪器B的名称是____________。
(2)在洗涤操作中,第一次水洗的主要目的是______,第二次水洗的主要目的是______。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是_________。
(5)实验中加入少量无水MgSO4的目的是_________。
(6)本实验的产率是________(填标号)。
a.30% b.40% c.60% d.90%
(7)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏______![]() 填“高”或“低”
填“高”或“低”![]() ,其原因是______。
,其原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如图所示,下列推断合理的是
![]()
A.向甲中通入CO2可增大c(NH4+)和c(SO42-)
B.为提高生产效率,通入的NH3和CO2越多越好
C.颠倒NH3与CO2的加入顺序不影响生产效率
D.最后一步得到(NH4)2SO4固体的操作为蒸干滤液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com