
【题目】工业上利用软锰矿浆进行烟气脱硫并制备MnSO4和Mg(OH)2的工艺流程如图所示(已知软锰矿的主要成分是MnO2,还含有Fe、A1、Mg、Zn、Ni、Si等元素)。

已知:Ksp[Mg(OH)2]=4.9×10-12,Kb(NH3·H2O)=1.8×10-5。
(1)“脱硫浸锰”中软锰矿浆吸收SO2的化学方程式为______________________。
(2)向浸出液中添加适量MnO2的作用是_____________;滤渣2的主要成分是__________。
(3)“沉锰”的离子方程式为____________________________。
(4)“沉锰”过程中pH和温度对Mn2+和Mg2+沉淀率的影响如图所示。
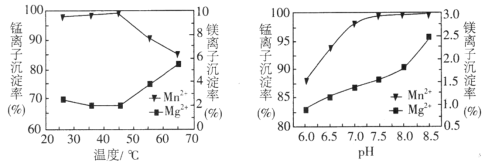
①由图可知,“沉锰”的合适条件是________________________。
②当温度高于45℃时,Mn2+和Mg2+沉淀率变化的原因是___________________________。
(5)将NH3通入0.015mol·L-1MgSO4溶液中,使Mg2+恰好完全沉淀即溶液中c(Mg2+)=1.0×10-5mol·L-1,此时溶液中NH3·H2O的物质的量浓度为________________(忽略反应前后溶液体积的变化,计算结果保留2位小数)。
【答案】MnO2+SO2=MnSO4 将Fe2+氧化为Fe3 NiS和ZnS Mn2++HCO3-+NH3·H2O=MnCO3↓+NH4++H2O 45℃、pH=7.5 当温度高于45℃时,随着温度升高,NH4HCO3分解,c(![]() )下降,所以Mn2+沉淀率下降;同时随着温度升高,Mg2+水解生成Mg(OH)2程度增大,所以Mg2+沉淀率增大 1.17mol·L-1
)下降,所以Mn2+沉淀率下降;同时随着温度升高,Mg2+水解生成Mg(OH)2程度增大,所以Mg2+沉淀率增大 1.17mol·L-1
【解析】
软锰矿的主要成分是MnO2,还含有Fe、A1、Mg、Zn、Ni、Si等元素,应均以金属氧化物的形式存在,SiO2、MnO2与硫酸不反应,硫酸酸化的软锰矿浆中含有Fe2+、A13+、Mg2+、Zn2+、Ni2+和SiO2、MnO2,通入含有SO2的烟气将二氧化硫吸收,二氧化硫与软锰矿浆中的MnO2作用生成生成Mn2+和SO42-,过滤后形成含有Mn2+、Fe2+、A13+、Mg2+、Zn2+、Ni2+、SO42-等的浸出液,二氧化硅不反应经过滤成为滤渣1,向浸出液中加入MnO2,将浸出液中的Fe2+氧化为Fe3+,加入氨水,调节pH值,使Fe3+、A13+形成Fe(OH)3、Al(OH)3沉淀除去,再向浸出液中加入硫化铵把Zn2+、Ni2+转化为NiS和ZnS沉淀除去,过滤后得到的滤渣2为NiS和ZnS,向过滤后的滤液中加入氨水和碳酸氢铵,得到碳酸锰和含有Mg2+的溶液,向碳酸锰中加入硫酸得到硫酸锰,向含有Mg2+的溶液通入氨气,得到氢氧化镁,据此分析解答。
(1)“脱硫浸锰”中软锰矿浆中,MnO2与SO2反应生硫酸锰,化学方程式为MnO2+SO2=MnSO4;
(2)根据分析,向浸出液中添加适量MnO2的作用是将浸出液中的Fe2+氧化为Fe3+;滤渣2的主要成分是NiS和ZnS;
(3)根据分析,向过滤后的滤液中加入氨水和碳酸氢铵,得到碳酸锰和含有Mg2+的溶液,“沉锰”的离子方程式为Mn2++HCO3-+NH3H2O=MnCO3↓+ NH4++H2O;
(4)①由图可知,“沉锰”的合适条件是:温度控制在45℃左右, pH=7.5左右锰离子的沉淀率最高;
②当温度高于45℃时,Mn2+和Mg2+沉淀率变化的原因是:沉锰是要加入碳酸氢铵,铵盐受热易分解,当温度高于45℃时,随着温度升高,NH4HCO3分解,c(CO32-)下降,所以Mn2+沉淀率下降;同时随着温度升高,Mg2+水解生成Mg(OH)2程度增大,所以Mg2+沉淀率增大;
(5) Ksp[Mg(OH)2]= c(Mg2+)×c2(OH-)=4.9×10-12,c2(OH-)=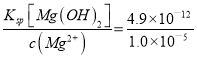 =4.9×10-7,c(OH-)=7×10-4mol·L-1,NH3通入0.015mol·L-1MgSO4溶液中,Mg2+恰好完全沉淀时生成硫酸铵,c(NH4+)= 2c(SO42-)=2×0.015 mol/L =0.03mol/L,一水合氨是弱电解质,电离方程式为:NH3·H2ONH4++OH-, Kb(NH3·H2O)=
=4.9×10-7,c(OH-)=7×10-4mol·L-1,NH3通入0.015mol·L-1MgSO4溶液中,Mg2+恰好完全沉淀时生成硫酸铵,c(NH4+)= 2c(SO42-)=2×0.015 mol/L =0.03mol/L,一水合氨是弱电解质,电离方程式为:NH3·H2ONH4++OH-, Kb(NH3·H2O)= =1.8×10-5,则NH3·H2O的物质的量浓度为
=1.8×10-5,则NH3·H2O的物质的量浓度为![]() =1.17mol/L。
=1.17mol/L。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】某元素的离子结构示意图为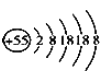 ,该离子显+1价,则该元素在周期表中的位置是( )
,该离子显+1价,则该元素在周期表中的位置是( )
A. 第5周期零族B. 第6周期第IB族
C. 第5周期第ⅦA族D. 第6周期第IA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是

A. 电流由O2所在的铂电极经外电路流向另一电极
B. O2所在的铂电极处发生还原反应
C. 该电池的负极反应式为:CH3CH2OH+3H2O-12e-="=" 2CO2↑+12H+
D. 微处理器通过检测电流大小而计算出被测气体中酒精的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
![]()
![]()
![]()
![]()
![]()
![]()
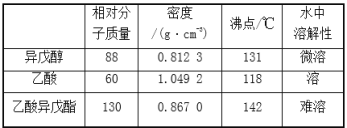
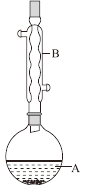
实验步骤:在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。下列问题:
(1)仪器B的名称是____________。
(2)在洗涤操作中,第一次水洗的主要目的是______,第二次水洗的主要目的是______。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是_________。
(5)实验中加入少量无水MgSO4的目的是_________。
(6)本实验的产率是________(填标号)。
a.30% b.40% c.60% d.90%
(7)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏______![]() 填“高”或“低”
填“高”或“低”![]() ,其原因是______。
,其原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸铁铵[(NH4)3Fe(C2O4)3]是一种常用的金属着色剂,易溶于水,常温下其水溶液的pH介于4.0~5.0之间。某兴趣小组设计实验制备草酸铁铵并测其纯度。
(1)甲组设计由硝酸氧化葡萄糖制取草酸,其实验装置(夹持及加热装置略去)如图所示。
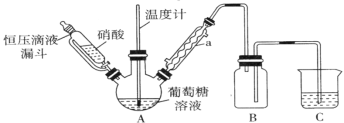
①仪器a的名称是________________。
②55~60℃下,装置A中生成H2C2O4,同时生成NO2和NO且物质的量之比为3:1,该反应的化学方程式为__________________________。
③装置B的作用是______________________;装置C中盛装的试剂是______________。
(2)乙组利用甲组提纯后的草酸溶液制备草酸铁铵。
将Fe2O3在搅拌条件下溶于热的草酸溶液;滴加氨水至__________,然后将溶液________、过滤、洗涤并干燥,制得草酸铁铵产品。
(3)丙组设计实验测定乙组产品的纯度。
准确称量5.000g产品配成100mL溶液,取10.00mL于锥形瓶中,加入足量0.1000mol·L-1稀硫酸酸化后,再用0.1000mol·L-1KMnO4标准溶液进行滴定,消耗KMnO4溶液的体积为12.00mL。
①滴定终点的现象是_______________________。
②滴定过程中发现褪色速率开始缓慢后迅速加快,其主要原因是____________________。
③产品中(NH4)3Fe(C2O4)3的质量分数为____________%。[已知:(NH4)3Fe(C2O4)3的摩尔质量为374g·mol-1]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.12 g 金刚石中含有的共用电子对数为NA
B.1 mol AlCl3在熔融时离子总数为0.4NA
C.0.2 mol MnO2与足量浓盐酸反应转移的电子数小于 0.4NA
D.1 L 0.1 mol·Lˉ1 Na2CO3溶液中含有阴离子数大于 0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究苯与溴的取代反应,甲同学用装置I进行如下实验:
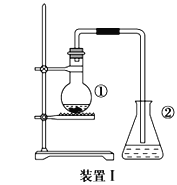
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑做催化剂,3-5分钟后发现滴有AgNO3溶液的锥形瓶中有浅黄色沉淀生成,即证明苯与溴发生了取代反应。
(1)装置I中①的化学方程式为__________________________________________________。
(2)①中长导管的作用是______________________________________________。
(3)要得到纯净的产物,可用稀NaOH溶液、蒸馏水洗涤。洗涤分离粗产品后,要进一步提纯,下列操作中必须的是________(填入正确选项前的字母);
A 重结晶 B 过滤 C 蒸馏 D 萃取
(4)乙同学设计如图所示装置II,并用下列某些试剂完成该实验。可选用的试剂是:苯、液溴、浓硫酸、氢氧化钠溶液、硝酸银溶液、四氯化碳。
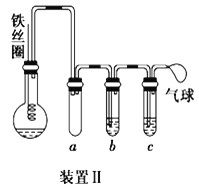
① 能证明苯和液溴发生的是取代反应,而不是加成反应,则试管b中应加入___________,其作用是_________________________;试管c中应加入________________。
② 比较两套装置,装置II的主要优点是_____________________________________。(答出一点即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如图所示,下列推断合理的是
![]()
A.向甲中通入CO2可增大c(NH4+)和c(SO42-)
B.为提高生产效率,通入的NH3和CO2越多越好
C.颠倒NH3与CO2的加入顺序不影响生产效率
D.最后一步得到(NH4)2SO4固体的操作为蒸干滤液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
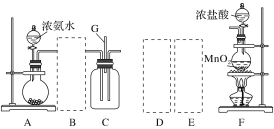
备选装置 | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
请回答下列问题:
(1)装置F中发生反应的离子方程式是___________________________________。
(2)装置A中的烧瓶内固体可选用________(填字母)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:
B:________、D:________、E:________。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:____________________________________;
(5)装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案确定该白色固体中的阳离子:_______________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com