
 室温下向10mL 0.1mol•L-1 NaOH溶液中逐滴加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.
室温下向10mL 0.1mol•L-1 NaOH溶液中逐滴加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.分析 (1)中和滴定需要用到铁架台(带蝴蝶夹)、酸式滴定管、碱式滴定管、锥形瓶;
(2)a点时酸碱恰好中和,溶质为NaA,NaA水解呈碱性,溶液中c(Na+)>c(A)>c(OH-)>c(H+);根据物料守恒判断;
(3)c点所示溶液呈中性,根据电荷守恒判断;
(4)b点溶质为等浓度的NaA和HA,HA的电离程度大于NaA的水解程度;
(5)酸或碱抑制水电离,含有弱根离子的盐促进水电离;
(6)根据c(待)=$\frac{c(标)×V(标)}{V(待)}$判断不当操作对V(标)的影响;
解答 解:(1)中和滴定需要用到铁架台(带蝴蝶夹)、酸式滴定管、碱式滴定管、锥形瓶;
故答案为:锥形瓶;
(2)a点时酸碱恰好中和,溶质为NaA,NaA水解呈碱性,A-的水解程度减小,溶液中c(Na+)>c(A)>c(OH-)>c(H+);a点所示溶液中溶质为NaA,根据物料守恒可得:c(Na+)=c(A-)+c(HA);
故答案为:NaA;c(Na+)>c(A-)>c(OH-)>c(H+);=;
(3)c点所示溶液呈中性,则c(OH-)=c(H+),由电荷守恒得:c(Na+)+c(H+)=c(A-)+c(OH-);
所以c(Na+)=c(A-);
故答案为:=;
(4)b点溶质为等浓度的NaA和HA,HA的电离程度大于NaA的水解程度,c(A-)>c(HA);
故答案为:>;
(5)根据图象知,该酸是弱酸,a、b、c点的溶质分别是盐、盐和酸、盐和酸,a点盐类水解促进水电离,b点盐类水解小于酸的电离,水的电离程度受到抑制,c点溶液呈中性,水的电离程度不受影响,所以a、b、c三点溶液中水的电离程度最大的是a;
故答案为:a;
(6)A、滴定管滴定前有气泡,滴定后气泡消失,导致V(HA)偏大,故A正确;
B、锥形瓶洗涤后没有干燥,NaOH的物质的量不变,导致V(HA)不变,故B错误;
C、滴定时锥形瓶中有液体溅出,NaOH的物质的量偏小,导致V(HA)偏小,故C错误;
D、最后一滴HA溶液附在锥形瓶内壁上未冲下,导致V(HA)偏大,故D正确;
E、滴定开始前读数时平视,滴定终点,读数时俯视,导致V(HA)偏小,故E错误;
故选AD.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:填空题
I.某温度时,在一个容积为2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
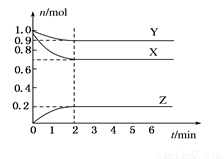
(1)该反应的化学方程式为_______________________。
(2)反应开始至2 min,气体Z的平均反应速率为____________。
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的____________倍;
②若此时将容器的体积缩小为原来的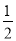 倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为____________反应(填“放热”或“吸热”)。
倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为____________反应(填“放热”或“吸热”)。
Ⅱ.某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应:4NO2(g)+O2(g) 2N2O5(g) ΔH<0的影响。
2N2O5(g) ΔH<0的影响。

(1)图像中T1和T2的关系是T1________T2(填“>”、“<”或“=”);
(2)比较a、b、c三点所处的平衡状态中,反应物NO2的转化率最大的是__________(填字母);
(3)若容器体积为1 L,n=1 mol,NO2的转化率为50%,则此条件下(T2),反应的平衡常数K=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量0.40g NaOH固体,在烧杯中加入100mL 水溶解即可 | |
| B. | 将称量好的固体NaOH放入100 mL容量瓶中,加蒸馏水溶解至环形刻线 | |
| C. | 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分 | |
| D. | 将烧杯中溶解固体NaOH所得溶液冷却到室温后,转移至容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| HX | HY | HZ | |
| 浓度 mol•L-1 | 0.1 0.5 | 1.0 1.5 | 2.0 2.5 |
| 电离度 | 0.3% 0.13% | 0.3% 0.24% | 0.5% 0.45% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b>c>d | B. | b>a=d>c | C. | b>a>d>c | D. | c>a=d>b |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Al3+、Ag+、NO3-、I- | B. | Mg2+、NH4+、NO3-、Cl- | ||
| C. | NH4+、K+、S2-、Br- | D. | Zn2+、Na+、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com